Absorbansi apa itu, contoh dan latihan diselesaikan
- 2573
- 544
- Jessie Harvey
Itu daya serap Ini adalah logaritma dengan tanda negatif dari hasil bagi antara intensitas cahaya yang muncul dan intensitas kejadian cahaya pada sampel larutan tembus cahaya yang telah diterangi dengan cahaya monokromatik. Hasil bagi ini adalah transmitansi.
Proses fisik bagian cahaya melalui sampel disebut transmisi bercahaya, Dan absorbansi adalah ukurannya. Oleh karena itu, absorbansi menjadi logaritma transmitansi terkecil dan merupakan fakta penting untuk menentukan konsentrasi sampel yang umumnya dilarutkan dalam pelarut seperti air, alkohol atau lainnya.
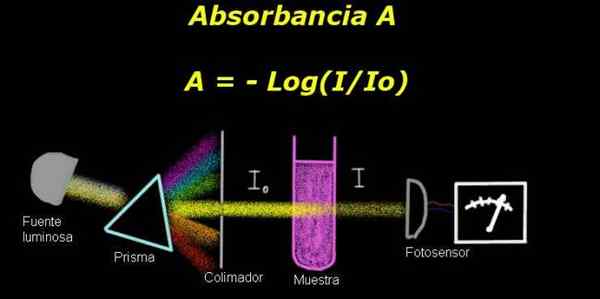
 Gambar 1. Skema proses absorbansi. Disiapkan oleh f. Zapata
Gambar 1. Skema proses absorbansi. Disiapkan oleh f. Zapata Untuk mengukur absorbansi, diperlukan perangkat Elektro-fotometer, dengan mana arus diukur yang sebanding dengan insiden intensitas bercahaya di permukaannya.
Saat menghitung transmitansi, sinyal intensitas yang sesuai dengan pelarut saja umumnya diukur dan hasil ini dicatat sebagai Io.
Kemudian sampel dilarutkan dalam pelarut dengan kondisi pencahayaan yang sama ditempatkan. Ukuran yang diukur dengan elektro-fotometer dilambangkan sebagai yo, yang memungkinkan Anda menghitung transmitansi T Menurut formula berikut:
T = i / isalah satu
Itu adalah kuantitas yang dilepaskan. Itu Absorbansi a Ini dinyatakan sebagai:
A = - log (t) = - log (i / isalah satu)
[TOC]
Absorbansi dan absorbasi molar
Molekul yang membentuk bahan kimia mampu menyerap cahaya, dan ukurannya adalah absorbansi yang tepat. Ini adalah hasil interaksi antara foton dan elektron molekuler.
Oleh karena itu adalah besarnya yang tergantung pada kepadatan atau konsentrasi molekul yang membentuk sampel dan juga jalur optik atau jarak yang ditempuh oleh cahaya.
Anda dapat melayani Anda: Hukum Ketiga Newton: Aplikasi, Eksperimen dan LatihanData eksperimental menunjukkan absorbansi itu KE sebanding secara linear dengan konsentrasi C dan jarak D Cahaya bepergian. Jadi untuk menghitungnya berdasarkan parameter ini, rumus berikut dapat ditetapkan:
A = ε⋅c⋅d
Dalam formula sebelumnya, ε Itu adalah konstanta proporsionalitas yang diketahui dengan nama Menyerap molar.
Penyerapan molar tergantung pada jenis zat dan panjang gelombang dengan mana absorbansi diukur. Itu Menyerap molar Ini juga sensitif terhadap suhu sampel dan pH yang sama.
Hukum Beer-Lambert
Hubungan antara absorbansi, penyerapan, konsentrasi, dan jarak dari ketebalan jalan yang diikuti oleh cahaya dalam sampel dikenal sebagai hukum bir-lambert.
 Gambar 2. Hukum bir - Lambert. Sumber: f. Zapata,
Gambar 2. Hukum bir - Lambert. Sumber: f. Zapata, Di bawah ada beberapa contoh cara menggunakannya.
Contoh
Contoh 1
Selama percobaan sampel dengan lampu merah lampu laser helium-neon, yang panjang gelombangnya 633 nm. Elektro-fotometer berukuran 30 mV saat cahaya laser mempengaruhi secara langsung dan 10 mV saat melewati sampel.
Dalam hal ini, transmitansi adalah:
T = i / io = 10 mV / 30 mV = ⅓.
Dan absorbansi adalah:
A = - log (⅓) = log (3) = 0.48
Contoh 2
Jika zat yang sama ditempatkan dalam wadah yang memiliki setengah tebal.
Harus dipertimbangkan bahwa jika ketebalan berkurang menjadi setengah, maka absorbansi yang sebanding dengan ketebalan optik berkurang setengahnya, yaitu A = 0,28. Ton transmitansi akan diberikan oleh hubungan berikut:
Dapat melayani Anda: bidikan vertikal: formula, persamaan, contohT = 10-a = 10^(-0.28) = 0,53
Elektro-fotometer akan menandai 0,53*30 mV = 15,74 mV.
Latihan terpecahkan
Latihan 1
Itu ingin menentukan penyerapan molar dari senyawa yang dipatenkan tertentu yang ada dalam larutan. Untuk ini, solusi dengan cahaya dari lampu natrium 589 nm diterangi. Sampel akan ditempatkan pada setebal 1,50 cm.
Ini didasarkan pada solusi konsentrasi 4,00 × 10^-4 mol per liter dan transmitansi diukur menghasilkan 0,06. Tentukan dengan data ini penyerapan molar sampel.
Larutan
Pertama -tama, absorbansi ditentukan, yang didefinisikan sebagai sepuluh transmitansi berbasis logaritma terkecil:
A = - log (t)
A = - log (0,06) = 1.22
Kemudian hukum Lambert-Beer digunakan yang menetapkan hubungan antara absorbansi, absorbasi molar, konsentrasi dan panjang optik:
A = ε⋅c⋅d
Membersihkan absorbity molar hubungan berikut diperoleh:
ε = a/(c⋅d)
mengganti nilai yang diberikan:
ε = 1.22/(4.00 × 10^-4 m⋅1.5 cm) = 2030 (m⋅cm)^-1
Hasil sebelumnya telah dibulatkan menjadi tiga digit yang signifikan.
Latihan 2
Untuk meningkatkan akurasi dan menentukan kesalahan ukuran penyerap molar sampel dalam Latihan 1, sampel secara berturut -turut diencerkan dalam setengah konsentrasi dan transmitansi diukur dalam setiap kasus.
Mulai dari CO = 4 × 10^-4 m dengan transmitansi t = 0,06 Urutan data berikut untuk transmitansi dan absorbansi yang dihitung dari transmitansi diperoleh:
CO/1-> 0,06-> 1.22
CO/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
CO/8-> 0,71-> 0,15
CO/16-> 0,83-> 0,08
CO/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
CO/128-> 0,98-> 0,01
CO/256-> 0,99-> 0,00
Dengan data ini, lakukan:
Ini dapat melayani Anda: Gelombang Stasioner: Rumus, Karakteristik, Jenis, Contoha) grafik absorbansi berdasarkan konsentrasi.
b) Penyesuaian linear data dan temukan lereng.
c) Dari kemiringan yang diperoleh, hitung penyerapan molar.
Larutan
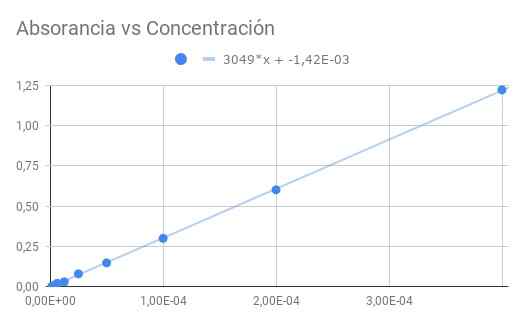 Gambar 3. Absorbansi vs konsentrasi. Sumber: f. Zapata.
Gambar 3. Absorbansi vs konsentrasi. Sumber: f. Zapata. Kemiringan yang diperoleh adalah produk dari molar absorganivitas dengan jarak optik, jadi membagi kemiringan dengan panjang 1,5 cm kita mendapatkan penyerap molar
ε = 3049/1.50 = 2033 (m⋅cm)^-1
Latihan 3
Dengan data Latihan 2:
a) Hitung absorganivitas untuk setiap data.
b) Tentukan nilai rata -rata untuk penyerapan molar, deviasi standarnya dan kesalahan statistik yang terkait dengan rata -rata.
Larutan
Penyerap molar dihitung untuk masing -masing konsentrasi yang diuji. Ingatlah bahwa kondisi pencahayaan dan jarak optik tetap diperbaiki.
Hasilnya untuk penyerapan molar adalah:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 dalam satuan 1/(M*cm).
Dari hasil ini kita dapat mengambil nilai rata -rata:
= 1998 (m*cm)^-1
Dengan standar deviasi: 184 (m*cm)^-1
Kesalahan rata -rata adalah standar deviasi dibagi dengan akar kuadrat dari nomor data, yaitu:
Δ = 184/9^0,5 = 60 (m*cm)^-1
Akhirnya, disimpulkan bahwa zat yang dipatenkan memiliki molar yang menyerap pada frekuensi 589 nm yang diproduksi oleh lampu natrium:
= (2000 ± 60) (m*cm)^-1
Referensi
- Atkins, hlm. 1999. Kimia Fisik. Edisi Omega. 460-462.
- Petunjuk. Transmitansi dan absorbansi. Dipulihkan dari: Kimia.LAGUIA2000.com
- Toksikologi lingkungan. Transmitansi, absorbansi dan hukum Lambert. Pulih dari: repositori.Inovasi.adalah
- Fisika Petualangan. Absorbansi dan transmitansi. Pulih dari: rpfisica.Blogspot.com
- Sistophotometry. Pulih dari: chem.Librettexts.org
- Toksikologi lingkungan. Transmitansi, absorbansi dan hukum Lambert. Pulih dari: repositori.Inovasi.adalah
- Wikipedia. Daya serap. Pulih dari: wikipedia.com
- Wikipedia. Spektrofotometri. Pulih dari: wikipedia.com
- « Konteks Avant -Garde Amerika Latin, Karakteristik, Penulis
- Totalitarianisme Asal, Karakteristik, Penyebab dan Konsekuensi »

