Menyerap molar
- 2318
- 276
- Ray Thiel
Apa itu penyerap molar?
Itu Menyerap molar Ini adalah sifat kimia yang menunjukkan seberapa banyak cahaya yang dapat menyerap suatu spesies dalam larutan. Yaitu, ini adalah unit yang mengukur kemampuan solusi untuk menyerap cahaya.
Karena cahaya terdiri dari foton dengan energi (atau panjang gelombang), tergantung pada spesies atau campuran campuran, foton dapat diserap ke tingkat yang lebih besar dari yang lain. Berarti bahwa cahaya diserap pada panjang gelombang tertentu dari zat tersebut.
Dengan demikian, nilai absorbitas molar berbanding lurus dengan tingkat penyerapan cahaya ke panjang gelombang tertentu. Jika spesies menyerap lampu merah kecil, nilai penyerapnya akan rendah. Jika ada penyerapan lampu merah yang jelas, penyerapan akan memiliki nilai tinggi.
Spesies yang menyerap cahaya merah akan memantulkan warna hijau. Jika warna hijau sangat intens dan gelap, itu berarti ada penyerapan cahaya merah yang kuat.
Namun, beberapa warna hijau mungkin disebabkan oleh refleks dari berbagai rentang kuning dan biru, yang dicampur dan dianggap hijau pirus, zamrud, kaca, dll.
Persamaan penyerap molar
Penyerapan molar adalah konstan yang didefinisikan dalam ekspresi matematika hukum Lambert-Beer, dan hanya menunjukkan seberapa banyak cahaya menyerap spesies kimia atau campuran. Persamaannya adalah:
A = εbc
Di mana A adalah absorbansi larutan ke panjang gelombang λ yang dipilih, B adalah panjang sel tempat sampel yang akan dianalisis terkandung, dan, oleh karena itu, jarak yang diteruskan oleh cahaya dalam larutan, C adalah yang konsentrasi spesies penyerap, dan ε, penyerap molar.
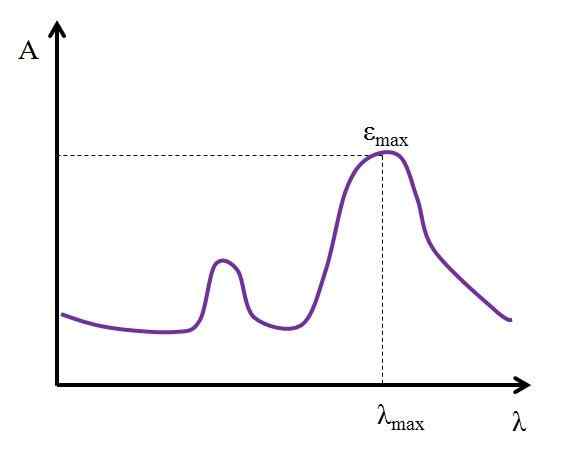
Itu bisa melayani Anda: alquinosDiberikan λ, dinyatakan dalam nanometer, nilai ε tetap konstan. Tetapi dengan mengubah nilai λ, yaitu, dengan mengukur absorbansi dengan lampu energi lain, ε berubah, mencapai nilai minimum atau maksimum.
Jika nilai maksimumnya diketahui, εMax, Itu ditentukan pada saat yang sama λMax. Artinya, cahaya yang paling menyerap spesies:
 Grafik di mana nilai penyerapan cahaya maksimum dari spesies kimia ditampilkan. Sumber: Gabriel Bolívar
Grafik di mana nilai penyerapan cahaya maksimum dari spesies kimia ditampilkan. Sumber: Gabriel Bolívar Unit
Untuk mengetahui unit ε, kita harus tahu bahwa absorbansi adalah nilai tanpa dimensi, dan, oleh karena itu, penggandaan unit B dan C harus dibatalkan.
Konsentrasi spesies penyerap dapat diekspresikan baik dalam G/L atau mol/L, dan B biasanya diekspresikan dalam CM atau M (karena panjang sel yang melintasi balok cahaya). Molaritas sama dengan mol/l, jadi c juga dinyatakan sebagai m.
Dengan demikian, mengalikan unit B dan C diperoleh: m ∙ cm. Unit yang ε harus meninggalkan nilai a adalah yang dengan berlipat ganda.
Membersihkan u, kamu hanya diperoleh m-1∙ cm-1, yang juga bisa ditulis sebagai: l ∙ mol-1∙ cm-1.
Faktanya, gunakan unit M-1∙ cm-1 atau l ∙ mol-1∙ cm-1 mempercepat perhitungan untuk menentukan penyerapan molar. Namun, itu juga biasanya diekspresikan dengan unit M2/mol atau cm2/mol.
Ketika diekspresikan dengan unit -unit ini, beberapa faktor konversi harus digunakan untuk memodifikasi unit B dan C.
Cara menghitung penyerapan molar?
Izin Langsung
Absorbitas molar dapat dihitung secara langsung dengan pembersihannya dalam persamaan sebelumnya:
Dapat melayani Anda: asam dan basa dalam kehidupan sehari -hari: reaksi, penggunaan, contohε = a/bc
Jika konsentrasi spesies penyerap diketahui, panjang sel, dan apa absorbansi yang diperoleh pada panjang gelombang, dapat dihitung ε. Namun, cara menghitung ini menghasilkan nilai yang tidak dapat diakses dan tidak dapat diandalkan.
Metode grafis
Jika persamaan hukum Lambert-Beer diamati dengan cermat, akan dicatat bahwa itu menyerupai persamaan garis (y = kapak+b).
Ini berarti bahwa jika nilai sumbu A adalah grafik. Dengan demikian, itu akan menjadi y, x akan menjadi c, dan itu setara dengan εb.
Oleh karena itu, grafik garis, cukup ambil dua poin untuk menentukan kemiringan, yaitu, ke. Setelah ini selesai, dan panjang sel, B, mudah untuk menghapus nilai ε.
Tidak seperti Direct Clearance, Grafik Vs. C memungkinkan Anda untuk mengukur serapan rata -rata dan mengurangi kesalahan eksperimental, dan juga, melalui satu titik mereka dapat melewati tak terbatas, sehingga pembersihan langsung tidak praktis.
Selain itu, kesalahan eksperimental dapat membuat garis tidak melewati dua, tiga titik atau lebih, sehingga garis yang diperoleh setelah menerapkan metode minimum persegi sebenarnya digunakan (fungsi yang sudah dimasukkan ke dalam kalkulator).
Semua ini dengan asumsi linearitas yang tinggi, dan oleh karena itu, kepatuhan terhadap hukum Lamber-Beer.
Latihan terpecahkan
Latihan 1
Diketahui bahwa larutan senyawa organik dengan konsentrasi 0.008739 m menghadirkan absorbansi 0.6346, diukur pada λ = 500 nm dan dengan sel 0.Panjang 5 cm. Hitung apa penyerap molar kompleks untuk panjang gelombang tersebut.
Dapat melayani Anda: Nikel: Sejarah, Properti, Struktur, Penggunaan, RisikoDari data ini dapat dihapus secara langsung ε:
ε = 0.6346/(0.5 cm) (0.008739 m)
145.23 m-1∙ cm-1
Latihan 2
Absorbansi berikut diukur pada konsentrasi yang berbeda dari kompleks logam pada panjang gelombang 460 nm, dan dengan sel panjang 1 cm: panjang:
A: 0.03010 0.1033 0.1584 0.3961 0.8093
C: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Hitung penyerapan molar kompleks.
Ada total lima poin. Untuk menghitung ε perlu untuk grafik mereka dengan menempatkan nilai a pada sumbu y. Setelah ini selesai, garis kotak minimum ditentukan, dan dengan persamaannya dapat ditentukan ε.
Dalam hal ini, poin grafik dan menggambar garis dengan koefisien penentuan r2 dari 0.9905, kemiringannya sama dengan 7 ∙ 10-4, yaitu, εb = 7 ∙ 10-4.
Oleh karena itu, dengan b = 1cm, ε akan 1428,57 m-1.cm-1 (1/7 ∙ 10-4).
Referensi
- Koefisien atenuasi molar. Diterima dari.Wikipedia.org
- Struct Sains. Absorptivitas molar. Pulih dari sciencestruck.com
- Analisis kolorimetri (hukum bir atau analisis spektrofotometri). Kimia pulih.UCLA.Edu

