Struktur amonium asetat, sifat, penggunaan dan risiko

- 971
- 170
- Dewey Runolfsdottir
Dia Ammonium asetat Ini adalah garam anorganik yang formula kimianya NH4Ch3Cooh. Berasal dari campuran asam asetat, hadir dalam cuka komersial hingga konsentrasi 5%, dan amonia. Kedua zat awal memiliki bau yang khas, jadi dimungkinkan untuk mendapatkan gambaran mengapa garam ini berbau seperti cuka-amonia.
Namun, yang paling menarik dari garam ini bukan baunya, tetapi titik lelehnya yang rendah. Sangat rendah, sehingga di laboratorium mana pun dapat diperoleh dalam versi cairnya, di mana ion mengalir dengan bebas untuk mengangkut beban listrik.
 Kristal amonium asetat. Sumber: Vidak [domain publik].
Kristal amonium asetat. Sumber: Vidak [domain publik]. Di sisi lain, amonium asetat lezat; yaitu, serap air atau kelembaban lingkungan sampai benar -benar larut. Itulah sebabnya, meskipun dalam keadaan anhidrat kristal mereka berwarna putih, mereka berubah dengan cepat cerah (seperti yang ada di gelas gambar atas gambar atas).
Menjadi sumber amonia yang kokoh, itu harus dimanipulasi sedemikian rupa sehingga inhalasi uapnya diminimalkan. Tapi, terlepas dari karakteristik negatif ini, NH4Ch3COOH berguna untuk persiapan solusi buffer yang disimpan makanan, sementara itu merupakan komponen ekstraktor protein pelarut tertentu.
[TOC]
Struktur amonium asetat
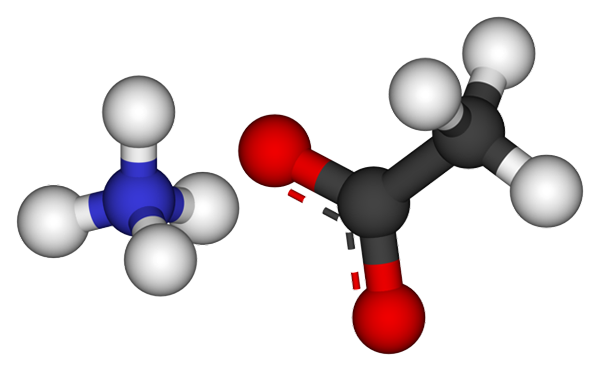 Ion amonium asetat. Sumber: CCOIL [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Ion amonium asetat. Sumber: CCOIL [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Gambar atas menunjukkan ion yang membentuk amonium asetat dalam model bola dan batang. Di sebelah kiri adalah kation geometri tetrahedral, NH4+, Sedangkan di sebelah kanan Anda anion molekuler dengan dua elektron yang didemokasikan antara dua atom oksigen, CH3Mendekut- (Garis putus -putus antara bidang merah).
Jadi kedua ion, NH4+ dan ch3Mendekut-, Mereka tetap bersatu dengan daya tarik elektrostatik mereka yang, bersama dengan tolakan antara beban yang sama, akhirnya mendefinisikan kristal. Kristal amonium asetat ini memiliki struktur ortorombik, yang dapat diamati dalam sampel mikroskopis atau bahkan ukuran yang terlihat.
Dapat melayani Anda: tautan ionik: karakteristik, bagaimana itu dibentuk dan contohTidak hanya ikatan ionik untuk garam ini penting, tetapi juga jembatan hidrogen. NH4+ Anda dapat menyumbangkan hingga empat jembatan ini; Yaitu, di masing -masing simpul tetrahedron -nya ada atom oksigen dari cho3Mendekut- tetangga (h3N+-H-och3).
Secara teori, kekuatan di dalam kristal mereka kemudian harus sangat kuat; Tetapi secara eksperimental sebaliknya terjadi, karena meleleh hanya 114 ° C. Oleh karena itu, jembatan hidrogen tidak mengkompensasi kelemahan ikatan ionik mereka, atau energi reticular rendah dari kaca ortorrhrombik NH4Ch3Mendekut.
Komposisi dan air lainnya
Dikatakan pada awalnya bahwa amonium asetat dibuat dengan mencampur asam asetat dan amonia. Oleh karena itu, garam juga dapat dinyatakan sebagai: NH3Ch3Cooh. Jadi, tergantung pada komposisi, struktur lain dapat diperoleh: NH3· 2ch3Cooh, o nh3· 5ch3Cooh, misalnya.
Juga disebutkan bahwa itu menyerap kelembaban yang cukup. Dengan melakukan itu, ia menggabungkan molekul air ke kristal, yang dihidrolisis memberikan NH3 atau ch3Cooh; Dan itulah sebabnya garam memancarkan aroma amonia atau cuka.
Properti
Penampilan fisik
Kristal putih lezat dengan aroma cuka dan amonia.
Masa molar
77.083 g/mol.
Kepadatan
1.073 g/ml pada 25ºC.
Titik lebur
114ºC. Nilai ini jauh lebih rendah dibandingkan dengan garam atau senyawa ion lainnya. Selain itu, tidak memiliki titik didih karena pembentukan amonia, menyiratkan dekomposisi garam.
Kelarutan
143 g/100 ml pada 20ºC. Perhatikan kelarutan air yang luar biasa, yang menunjukkan afinitas yang dirasakan molekul air pada ion NH4+ dan ch3Mendekut-, Mengayunkannya di bola berair.
Dapat melayani Anda: aturan hume-rotheryKelarutannya tidak seperti itu dalam pelarut polar yang kurang. Misalnya, dalam 100 mL metanol pada 15ºC 7,89 g NH larut4Ch3Mendekut.
Stabilitas
Itu lezat, jadi Anda harus menghindari penyimpanan di ruang basah. Juga, saat menyerap air membebaskan amonia, dan karenanya, ia membusuk.
PKA
9.9.
Konstanta ini sesuai dengan keasaman ion amonium:
NH4+ + B nh3 + HB
Dimana HB adalah asam lemah. Jika basis B adalah air, reaksi hidrolisisnya akan menjadi reaksi:
NH4+ + H2Atau nh3 + H3SALAH SATU+
Di mana spesies h3SALAH SATU+ Tentukan pH larutan.
Di sisi lain, asetat juga berkontribusi pada pH:
Ch3Mendekut- + H2Atau ch3COOH + OH-
Dengan demikian, kedua spesies H3SALAH SATU+ dan oh- Mereka dinetralkan dengan memberikan pH 7, netral. Namun, menurut PubChem, larutan amonium asetat yang sangat terkonsentrasi memiliki pH asam; yang berarti hidrolisis NH mendominasi4+ Tentang memilih3Mendekut-.
Entalpi pelatihan standar
ΔFH298 = -615 kJ/mol.
Aplikasi
Analitik
Larutan natrium asetat berair memungkinkan timbal, besi dan seng sulfat untuk dilarutkan, untuk selanjutnya menentukan konsentrasinya dengan spektroskopi serapan atom.
Setengah pengemudi
Sebagai makanan suhu rendah dibandingkan dengan garam lainnya, cairannya dapat digunakan untuk menggerakkan arus listrik yang menyalakan sirkuit bohlam.
Penyangga
Anda dapat mengatur perubahan pH dalam interval asam atau basa, yang digunakan untuk mempertahankan pH konstan, misalnya, daging, cokelat, keju, sayuran atau produk makanan lainnya.
Dapat melayani Anda: molibdenumDi atas es dan lantai
Ini adalah garam yang terbiodegradasi dan relatif murah, digunakan untuk mencairkan jalur es. Juga, karena merupakan sumber nitrogen yang larut dalam air, ini dimaksudkan untuk penggunaan pertanian untuk penentuan kadar kalium.
Agen pencetus
Garam ini digunakan untuk mengendapkan protein untuk melakukan analisis kromatografi.
Obat
Amonium asetat berfungsi sebagai agen diuretik veteriner, dan juga merupakan garam yang diperlukan untuk sintesis insulin dan penisilin.
Risiko
Berikutnya dan akhirnya beberapa risiko atau konsekuensi negatif yang disebabkan oleh amonium asetat terdaftar:
- Itu dapat menyebabkan sedikit iritasi pada kulit, tetapi tanpa menyerap di dalamnya.
- Saat dicerna menyebabkan lambung, diare, diuresis, kecemasan, kebutuhan yang lebih besar untuk buang air kecil, tremor dan gejala lain yang terkait dengan keracunan amonia, serta merusak hati.
- Inhalasinya mengiritasi hidung, tenggorokan dan paru -paru.
Dari sisanya, tidak diketahui apakah kanker dapat menghasilkan, dan kemungkinan risiko api oleh garam ini dibuang (setidaknya dalam kondisi penyimpanan normal).
Referensi
- Inger Nahringbauer. (1967). Studi Obligasi Hidrogen. Xiv. Struktur kristal amonium asetat. Institut Kimia, Universitas Uppsala, Uppsala, Swedia. Cryst Act. 23, 956.
- Pusat Nasional Informasi Bioteknologi. (2019). Ammonium asetat. Database pubchem. CID = 517165. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Sullivan Randy. (2012). Konduktivitas amonium asetat. Pulih dari: chemdemos.Uoregon.Edu
- Viachem, Ltd. (S.F.). Ammonium asetat. Pulih dari: viacheminc.com
- Wikipedia. (2019). Ammonium asetat. Diperoleh dari: di.Wikipedia.org
- Departemen Kesehatan New Jersey. (2012). Ammonium Acetate: Lembar Informasi tentang Zat Berbahaya. [PDF]. Pulih dari: NJ.Pemerintah
- Xueyanghu. (S.F.). Penggunaan dan Risiko Amonium Asetat. Pulih dari: xueyanghu.WordPress.com
- « Karakteristik alizarin, persiapan, penggunaan dan toksisitas
- Struktur, Properti dan Penggunaan Besi Hydroxide (III) »

