Alkohol sekunder apa, struktur, sifat, penggunaan
- 2268
- 516
- Irvin Reichel
Apa itu alkohol sekunder?
A alkohol sekunder Ini memiliki karbon karbon dari gugus hidroksil (OH), melekat pada dua karbon. Sementara itu, dalam alkohol primer karbon karbon dari gugus hidroksil terkait dengan atom karbon, dan dalam alkohol tersier yang melekat pada tiga atom karbon.
Alkohol adalah asam yang sedikit lebih lemah daripada air, dengan PKA berikut: air (15,7); Metil alkohol (15,2), etil (16), isopropil (alkohol sekunder, 17), dan termal (18). Seperti dapat dilihat, alkohol isopropil kurang asam daripada metil dan etil alkohol.
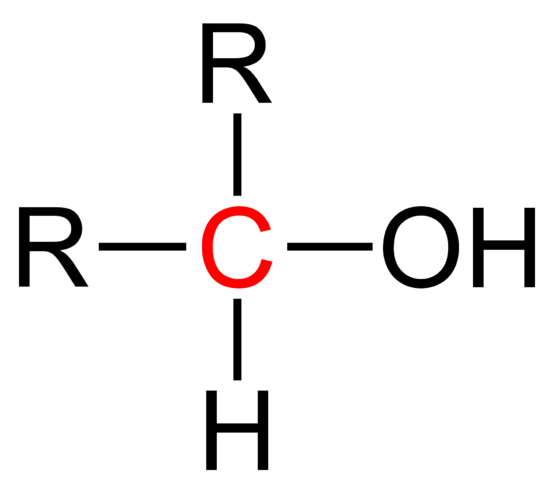
 Formula struktural alkohol sekunder. Wikimedia Commons
Formula struktural alkohol sekunder. Wikimedia Commons Pada gambar atas formula struktural untuk alkohol sekunder ditampilkan. Karbon Merah adalah pembawa OH, dan terkait dengan dua kelompok alkil (atau aril) dan satu atom hidrogen tunggal.
Semua alkohol memiliki formula generik ROH; Tetapi jika pembawa karbon diamati secara rinci, maka alkohol primer diperoleh (RCH2Oh), sekunder (r2Choh, dibesarkan di sini), dan tersier (r3COH). Fakta ini membuat perbedaan dalam sifat fisik dan reaktivitasnya.
Struktur alkohol sekunder
Struktur alkohol tergantung pada sifat kelompok R. Namun, untuk alkohol sekunder, beberapa contoh dapat dibuat, mengingat bahwa hanya ada struktur linier dengan atau tanpa konsekuensi, atau struktur siklik. Misalnya, Anda memiliki gambar berikut:
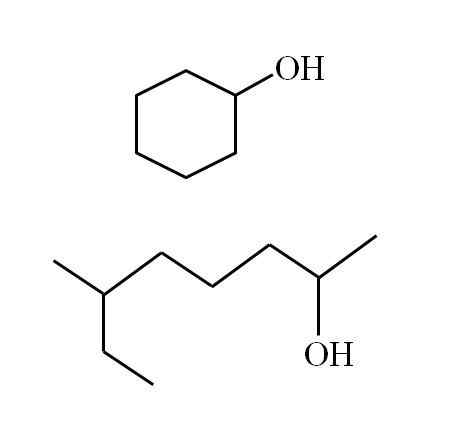 Alkohol sekunder siklik dan rantai bercabang lainnya. Sumber: Gabriel Bolívar
Alkohol sekunder siklik dan rantai bercabang lainnya. Sumber: Gabriel Bolívar Perhatikan bahwa untuk kedua struktur ada kesamaan: oh dikaitkan dengan "v". Setiap ujung V mewakili kelompok yang sama (bagian atas gambar, struktur siklik) atau berbeda (bagian bawah, rantai bercabang).
Dengan cara ini setiap alkohol sekunder sangat mudah diidentifikasi, bahkan jika nomenklaturnya tidak diketahui sama sekali.
Properti
Titik mendidih
Sifat alkohol sekunder tidak terlalu berbeda dari alkohol lain. Mereka biasanya cairan transparan, dan menjadi padatan pada suhu kamar, perlu membentuk beberapa jembatan hidrogen dan memiliki massa molekul tinggi.
Itu dapat melayani Anda: asam perbromic (HBRO4): sifat, risiko dan penggunaanNamun, formula struktural yang sama2Choh menyarankan sifat unik tertentu secara umum untuk alkohol ini. Misalnya, kelompok OH kurang terpapar dan tersedia untuk interaksi jembatan hidrogen, r2Ch-oh-ohchr2.
Ini karena kelompok R, berdekatan dengan karbon karbon mobil, dapat dibawa dan menghambat pembentukan jembatan hidrogen. Akibatnya, alkohol sekunder memiliki titik didih yang lebih rendah daripada primer (RCH2OH).
Keasaman
Menurut definisi Brönsted-Lowry, asam adalah yang menyumbangkan proton atau ion hidrogen, h+. Ketika ini terjadi dengan alkohol sekunder, Anda memiliki:
R2Choh + b- => R2Cho- + HB
Ras konjugat2Cho-, Anion alkohol, beban negatif Anda harus stabil. Untuk alkohol sekunder, stabilisasi lebih rendah karena kedua kelompok R memiliki kepadatan elektronik, yang mengusir beban negatif pada atom oksigen ke tingkat tertentu.
Sementara itu, untuk anion alkoksida alkohol primer, RCH2SALAH SATU-, Ada sedikit tolakan elektronik yang hanya memiliki satu kelompok R dan bukan dua. Selain itu, atom hidrogen tidak melakukan tolakan yang signifikan, dan sebaliknya, mereka berkontribusi untuk menstabilkan beban negatif.
Oleh karena itu, alkohol sekunder kurang asam daripada alkohol primer. Jika demikian, maka mereka lebih mendasar, dan justru karena alasan yang sama:
R2Choh + h2B+ => R2Choh2+ + HB
Sekarang, kelompok R menstabilkan beban positif dalam oksigen dengan memberikan sebagian dari kepadatan elektronik mereka.
Reaksi
Hidrogen halogenida dan fosfor trihalogenida
Alkohol sekunder dapat bereaksi dengan hidrogen halogenida. Persamaan kimia dari reaksi antara isopropil alkohol dan asam bromyteric ditunjukkan dalam sarana asam sulfat, dan menghasilkan isopropil bromida:
Ch3Chohch3 + Hbr => ch3Chbrch3 + H2SALAH SATU
Dan Anda juga dapat bereaksi dengan trihalogenuero fosfor, px3 (X = br, i):
Itu dapat melayani Anda: nikel hidroksida (III): struktur, sifat, penggunaan, risikoCh3-Choh-ch2-Ch2-Ch3 + Pbr3 => CH3-CHBR-CH2-Ch2-Ch3 + H3PO3
Bahan kimia di atas sesuai dengan reaksi antara bagian dan fosfor tribromide, menyebabkan sec-pentil bromida.
Perhatikan bahwa dalam kedua reaksi ada alkil halogenida sekunder (r2Chx).
Dehidrasi
Dalam reaksi ini H dan OH karbon tetangga hilang, membentuk ikatan rangkap antara kedua atom karbon ini. Oleh karena itu, ada pembentukan alkena. Reaksi membutuhkan katalis asam dan suplai panas.
Alkohol => alkene + h2SALAH SATU
Anda memiliki misalnya reaksi berikut:
Cyclohexanol => cyclohexen + h2SALAH SATU
Reaksi dengan logam aktif
Alkohol sekunder dapat bereaksi dengan logam:
Ch3-Choh-ch3 + K => cho3Cho-K+Ch3 + ½ jam+
Di sini isopropil alkohol bereaksi dengan kalium untuk membentuk kalium isoproksida dan ion hidrogen.
Esterifikasi
Alkohol sekunder bereaksi dengan asam karboksilat untuk berasal dari ester. Sebagai contoh, persamaan kimia dari reaksi alkohol sechutilic ditunjukkan dengan asam asetat, untuk menghasilkan semi-butil asetat:
Ch3Chohch2Ch3 + Ch3COOH CH3Coochch3Ch2Ch3
Oksidasi
Alkohol primer mengoksidasi aldehida, dan ini pada gilirannya mengoksidasi asam karboksilat. Tapi, alkohol sekunder mengoksidasi aseton. Reaksi biasanya dikatalisis oleh kalium dikromat (k2Cro7) dan asam kromik (h2Cro4).
Reaksi global adalah:
R2Choh => r2C = O
Tata nama
Alkohol sekunder ditunjuk dengan menunjuk ke posisi kelompok OH di rantai utama (lebih lama). Nomor ini mendahului namanya, atau dapat mengejar nama masing -masing alkana untuk rantai tersebut.
Misalnya, Cho3Ch2Ch2Ch2Chohch3, Itu adalah 2-hexanol atau hexan-2-to.
Jika strukturnya siklus, tidak perlu menempatkan pembilang; Kecuali ada substituen lain. Itulah sebabnya alkohol siklus gambar kedua disebut cyclohexanol (cincin itu heksagonal).
Dapat melayani Anda: aminaDan untuk alkohol lain dari gambar yang sama (bercabang), namanya adalah: 6-etil-heptan-2 -ol.
Aplikasi
-SEC-BUTANOL digunakan sebagai bahan kimia pelarut dan menengah. Ini hadir dalam cairan hidrolik untuk rem, pembersih industri, pemolesan, pint, agen flotasi mineral, dan buah -buahan dan esensi parfum.
-Alkohol isopropanol digunakan sebagai pelarut industri dan sebagai antikoagulan. Ini digunakan dalam minyak dan tinta pengeringan cepat, seperti antiseptik dan pengganti etanol kosmetik (misalnya: lotion kulit, tonik kapiler dan alkohol gesekan).
-Isopropanol adalah bahan sabun cair, pembersih kristal, aromatizer sintetis dari minuman dan makanan non -alkohol. Selain itu, ini adalah bahan kimia perantara.
-Cyclohexanol digunakan sebagai pelarut, di finish jaringan, dalam pemrosesan kulit dan sabun pengemulsi, dan deterjen sintetis.
-Methylciclohexanol adalah bahan produk kunyah berdasarkan sabun dan deterjen untuk jaringan khusus.
Contoh
2-octhanol
 2-ortanol molekul. Sumber: Jü [domain publik], dari Wikimedia Commons
2-ortanol molekul. Sumber: Jü [domain publik], dari Wikimedia Commons Itu adalah alkohol berlemak. Ini adalah cairan tidak berwarna, sedikit larut dalam air, tetapi larut dalam sebagian besar pelarut non -polar. Ini digunakan, di antara penggunaan lain, dalam elaborasi rasa dan wewangian, lukisan dan pelapis, tinta, perekat, perawatan rumah tangga dan pelumas.
Estradiol atau 17β-stradiol
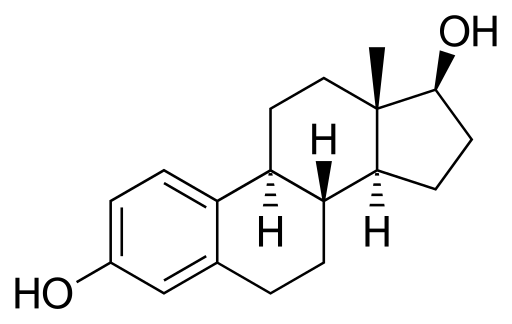 Molekul estradiol. Sumber: Neurotoger [domain publik], dari Wikimedia Commons
Molekul estradiol. Sumber: Neurotoger [domain publik], dari Wikimedia Commons Ini adalah hormon seksual steroid. Ia memiliki dua kelompok hidroksi dalam strukturnya. Itu adalah estrogen dominan selama tahun -tahun reproduksi.
20-hydroxy-leukotriene
Ini adalah metabolit yang mungkin berasal dari oksidasi lipid leukotriene. Itu diklasifikasikan sebagai sistinil leukotriene. Senyawa ini adalah mediator proses inflamasi yang berkontribusi pada karakteristik patofisiologis rinitis alergi.
2-heptanol
Itu adalah alkohol yang ditemukan dalam buah -buahan. Selain itu, ditemukan dalam minyak jahe dan stroberi. Itu transparan, tidak berwarna dan tidak larut dalam air. Ini digunakan sebagai pelarut dari beberapa resin dan campur tangan dalam fase flotasi dalam pemrosesan mineral.
Referensi
- Ensiklopedia kesehatan dan keselamatan di tempat kerja. (S.F.). Alkohol. [PDF]. Pulih dari: insht.adalah
- Struktur dan klasifikasi alkohol. Libretteks Kimia. Pulih dari: chem.Librettexts.org

