Alosterisme Aspek Umum, Fungsi dan Contoh
- 829
- 55
- Frederick Pfeffer
Dia Alosterisme o Regulasi alostrik didefinisikan sebagai proses penghambatan atau aktivasi enzim yang dimediasi oleh molekul pengatur yang berbeda dari substratnya dan bertindak di situs spesifik strukturnya, berbeda dari situs aktif yang sama.
Istilah "alosterik" atau "alosterisme" berasal dari akar Yunani "allos ", yang berarti "yang lain" dan "Stereós", yang berarti "bentuk" atau "tempat"; Jadi secara harfiah diterjemahkan sebagai "ruang lain", "tempat lain" atau "struktur lain".
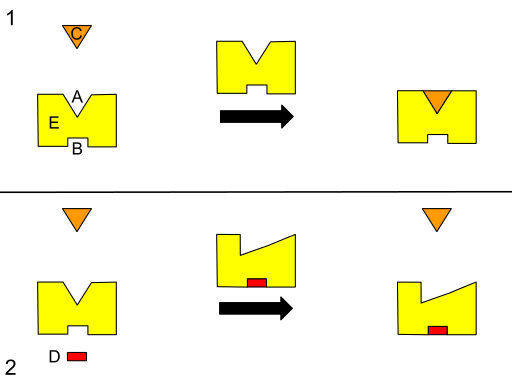
 Skema grafis A TO THEOSTERIC REGULASI. (A) Situs aktif. (B) situs alosterik. (C) Substrat. (D) inhibitor. (E) enzim. (Sumber: Isaac Webb [CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0)] via Wikimedia Commons)
Skema grafis A TO THEOSTERIC REGULASI. (A) Situs aktif. (B) situs alosterik. (C) Substrat. (D) inhibitor. (E) enzim. (Sumber: Isaac Webb [CC BYS-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0)] via Wikimedia Commons) Beberapa penulis menggambarkan alosterisme sebagai proses dimana situs -situs jarak jauh dalam suatu sistem (struktur enzim, misalnya) secara energik digabungkan untuk menghasilkan respons fungsional, itulah sebabnya dapat diasumsikan bahwa perubahan di suatu wilayah dapat mempengaruhi yang lain pada bagian yang sama.
Jenis regulasi ini khas dari enzim yang berpartisipasi dalam beberapa proses biologis yang diketahui, seperti transduksi sinyal, metabolisme (anabolisme dan katabolisme), regulasi ekspresi genetik, antara lain.
Gagasan pertama tentang alosterisme dan partisipasi mereka dalam kontrol metabolisme seluler dipostulatkan pada 1960 -an oleh f. Monod, f. Jacob dan J. Changeux, saat mempelajari rute biosintetik dari asam amino yang berbeda, yang dihambat setelah akumulasi produk akhir.
Meskipun publikasi pertama dalam hal ini berkaitan dengan regulasi genetik, beberapa waktu kemudian Monod, Wyman dan Changeux memperluas konsepsi alosterisme ke protein dengan aktivitas enzimatik dan mengusulkan model berdasarkan protein multimeric, terutama didukung oleh interaksi antara subunit ketika ada subunit ketika ada subunit ketika salah satu salah dari ini bergabung dengan efektor.
Dapat melayani Anda: guanina: karakteristik, struktur, pelatihan dan fungsiBanyak konsep selanjutnya memiliki dasar dalam teori "penyesuaian yang diinduksi" yang diperkenalkan oleh Koshland beberapa tahun sebelumnya.
[TOC]
Fitur Umum
Secara umum, semua enzim memiliki dua situs berbeda untuk ligan serikat: satu dikenal sebagai situs aktif, yang bergabung dengan molekul yang berfungsi sebagai substrat (bertanggung jawab untuk aktivitas biologis enzim), dan yang lain diketahui sebagai teosterik situs, yang khusus untuk metabolit lainnya.
"Metabolit lain" ini disebut efektor alestheric dan dapat memiliki efek positif atau negatif pada kecepatan reaksi yang dikatalisis oleh enzim atau dalam afinitas yang dengannya mereka bergabung dengan substrat mereka di situs aktif.
Biasanya, penyatuan efektor pada AL, situs enzim menyebabkan efek pada situs lain dari struktur, memodifikasi aktivitas atau kinerja fungsionalnya.
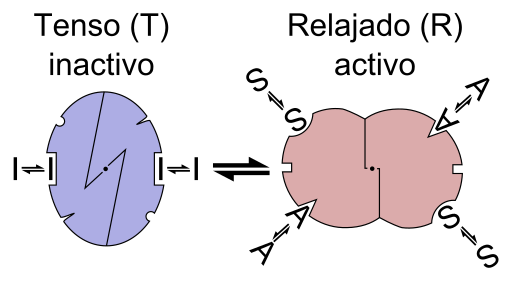 Skema grafis reaksi enzim alosterica (sumber: file: enzim alostery is.PNG: File: Enzim Allostery.PNG: Alostery.PNG: Nicolas Le Novere (Talk).Lenov di dalam.Pekerjaan Wikipediaderivatif: Timvickers (Talk) Pekerjaan Derivatif: Retama (bicara) Pekerjaan Derivatif: Kes47 [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons)
Skema grafis reaksi enzim alosterica (sumber: file: enzim alostery is.PNG: File: Enzim Allostery.PNG: Alostery.PNG: Nicolas Le Novere (Talk).Lenov di dalam.Pekerjaan Wikipediaderivatif: Timvickers (Talk) Pekerjaan Derivatif: Retama (bicara) Pekerjaan Derivatif: Kes47 [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/3.0) Via Wikimedia Commons) Dengan kata lain, penyatuan efektor alestro ke tempat spesifiknya dalam struktur enzim menyebabkan perubahan dalam geometri molekuler enzim, yang dikenal sebagai transisi ke posterom, yaitu, itu adalah peristiwa yang ditransmisikan di seluruh makromolekul, memodifikasi perilakunya.
Alosterisme bisa homotropik atau heterotropik. Proses regulasi alostroik homotropik didefinisikan sebagai proses di mana substrat yang sama dari suatu enzim bertindak sebagai regulator alestriknya, yaitu, bahwa efektor alosterik adalah substrat yang sama; Ini juga dikenal sebagai jenis koperasi.
Proses regulasi heterotropik, di sisi lain, mengacu pada regulasi aktivitas enzim yang dimediasi oleh molekul atau efektor dari posteromis yang berbeda dari substratnya, dan juga dapat memiliki efek positif atau negatif pada aktivitas enzim tersebut.
Itu dapat melayani Anda: Aptenia cordifolia: karakteristik, habitat, sifat, budidayaFungsi
Alosterisme, bersama dengan regulasi ekspresi genetik, terjemahan, dan degradasi protein, adalah salah satu mekanisme mendasar untuk regulasi sejumlah besar proses organik, yang penting untuk pemeliharaan homeostasis dan untuk kelangsungan hidup semua kehidupan, uniseluler atau multiseluler makhluk.
Regulasi Toostal atau Alosterisme memberi organisme hidup kemampuan untuk merespons dengan sensitivitas yang besar terhadap perubahan konsentrasi ligan regulasi, serta yang berasal dari fenomena ritmik pada tingkat seluler.
Karena substrat energi dan metabolisme terbatas dalam sel, alosterisme memungkinkan, di bidang metabolisme, penggunaan sumber daya yang sedang, menghindari siklus yang tidak berguna dan pemborosan energi untuk pemrosesan substrat yang berlebihan dalam kondisi kelimpahan atau kekurangan.
Demikian pula, mekanisme regulasi ini sangat penting untuk proses pensinyalan sel, di mana banyak perubahan konformasi yang dipicu oleh penyatuan ligan yang berbeda di situs spesifik reseptor yang dipertanyakan.
Contoh alosterisme
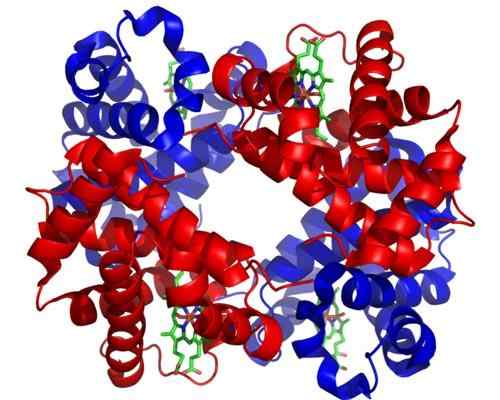 Hemoglobin. Diambil dan diedit dari: Zephyris di bahasa Inggris Wikipedia [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]].
Hemoglobin. Diambil dan diedit dari: Zephyris di bahasa Inggris Wikipedia [CC BY-SA 3.0 (http: // createveCommons.Org/lisensi/by-sa/3.0/]]. Meskipun ada ribuan contoh Toosterism atau Regulasi di Alam, beberapa lebih menonjol daripada yang lain. Begitulah kasus hemoglobin, yang merupakan salah satu protein pertama yang dijelaskan secara mendalam dalam aspek struktural.
Hemoglobin adalah protein yang sangat penting bagi banyak hewan, karena bertanggung jawab atas pengangkutan oksigen melalui darah dari paru -paru ke jaringan. Protein ini menyajikan homotropik dan heterotropik untuk regulasi posteric.
Dapat melayani Anda: Saltacionisme: Karakteristik, Bukti, dan ContohAlosterisme homotropik hemoglobin berkaitan dengan penyatuan molekul oksigen ke salah satu subunit yang menyusunnya secara langsung mempengaruhi afinitas yang dengannya subunit yang berdekatan dengan molekul oksigen lain mengikat, meningkatkannya (regulasi positif atau kooperatifisme).
Heterotropik ke heterotropik
Alosterisme heterotropik, di sisi lain, terkait dengan efek pH dan adanya 2,3-diffogllycerate pada penyatuan oksigen ke subunit enzim ini, menghambatnya.
Transcarbamilase atau atcasa aspartate, yang berpartisipasi dalam rute sintesis pirimidin, juga merupakan salah satu contoh "klasik" dari regulasi alosterik. Enzim ini, yang memiliki 12 subunit, di mana 6 di antaranya aktif secara katalitik dan 6 adalah regulator, dihambat secara heterotropik oleh produk akhir dari rute yang mengepalai, cytidininatrifosphate (CTP).
Operon laktosa DAN. coli
Buah dari ide -ide pertama Monod, Jacob dan Changeaux adalah sebuah artikel yang diterbitkan oleh Jacob dan Monod terkait dengan laktosa laktosa laktosa Escherichia coliyo, yang merupakan salah satu contoh peraturan heterotropik untuk tingkat genetik.
Regulasi toostal sistem ini tidak terkait dengan kemampuan untuk mengubah substrat menjadi suatu produk, tetapi dengan afinitas penyatuan protein ke wilayah DNA yang beroperasi.
Referensi
- Changeux, J. P., & Edelstein, s. J. (2005). Mekanisme alosterik transduksi sinyal. Sains, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, g. (1990). Regulasi alosterik, osilasi kerjasama, dan biokimia. Kimia Biofisika, 37 (1-3), 341-353.
- Jiao, w., & Parker, dan. J. (2012). Menggunakan kompinasi teknik komputasi dan eksperimental untuk memahami dasar molekuler untuk alostery protein. Dalam kemajuan dalam kimia protein dan biologi struktural (vol. 87, hlm. 391-413). Pers Akademik.
- Kern, d., & Zuiderweg, dan. R. (2003). Peran dinamika dalam regulasi alosterik. Opini Saat Ini dalam Biologi Struktural, 13 (6), 748-757.
- Laskowski, r. KE., Gerick, f., & Thornton, J. M. (2009). Dasar struktural regulasi alosterik dalam protein. Surat Febs, 583 (11), 1692-1698.
- Mathews, c. K., Van Holde, K. DAN., & Ahern, k. G. (2000). Biokimia, ed. San Francisco, Calif.
- « Struktur Nanotube Karbon, Properti, Aplikasi, Toksisitas
- Proses, jenis dan contoh radiasi adaptif »

