Alkynes
- 3225
- 754
- Leland Robel
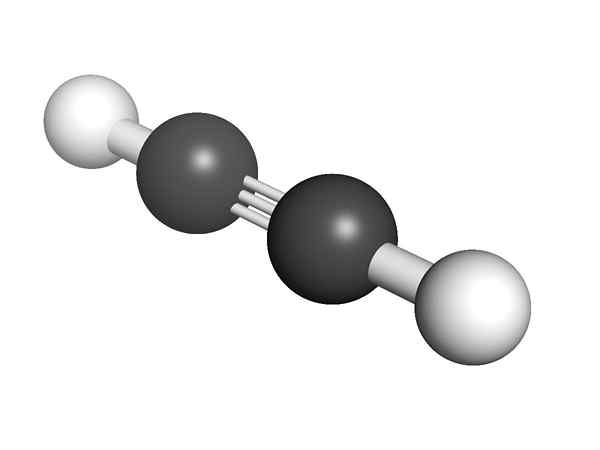
 Struktur Alvento, dengan triple link
Struktur Alvento, dengan triple link Apa itu alkin?
Itu Alkynes Mereka adalah hidrokarbon atau senyawa organik yang hadir dalam strukturnya triple link antara dua karbon. Triple Link ini (≡) ini dianggap sebagai kelompok fungsional ketika mewakili situs aktif molekul, dan karenanya bertanggung jawab atas reaktivitasnya.
Meskipun alkin tidak banyak berdiferensiasi dari alko atau alkena, mereka menunjukkan keasaman dan polaritas yang lebih besar karena sifat hubungan mereka. Istilah yang tepat untuk menggambarkan sedikit perbedaan ini adalah apa yang dikenal sebagai tidak jenuh.
Alkana adalah hidrokarbon jenuh, sedangkan alkine adalah yang paling tak jenuh sehubungan dengan struktur aslinya. Apa artinya ini? Itu adalah alkane h3C-ch3 (etana) dapat menjadi dehidrogen ke h2C = ch2 (Etene) dan selanjutnya HCHCHCH (Etino, atau lebih dikenal sebagai asetilena).
Perhatikan bagaimana tautan tambahan terbentuk di antara karbon mengurangi jumlah hidrogen yang terkait dengan mereka. Karbon, karena karakteristik elektroniknya, berupaya membentuk empat tautan sederhana, sehingga semakin besar kecenderungan untuk bereaksi (kecuali untuk senyawa aromatik).
Di sisi lain, triple link jauh lebih kuat dari ganda (=) atau ikatan sederhana (-), tetapi dengan biaya energi tinggi. Oleh karena itu, sebagian besar hidrokarbon (alkana dan alkena) dapat membentuk ikatan rangkap tiga pada suhu tinggi.
Sebagai konsekuensi dari energi yang tinggi dari ini, saat pecah mereka melepaskannya dengan sangat panas. Contoh fenomena ini dapat dilihat ketika asetilena terbakar dengan oksigen dan panas yang intens dari nyala api untuk mengelas atau melelehkan logam digunakan.
Asetilena adalah alkinye paling sederhana dan paling kecil dari semuanya. Hidrokarbon lain dapat diekspresikan dari formula kimianya dengan mengganti H dengan gugus alquilis (RCHCR '). Hal yang sama terjadi di dunia sintesis organik melalui sejumlah besar reaksi.
Alkyne ini terjadi dari reaksi kalsium oksida batu kapur dan koque, bahan baku yang menyediakan karbon yang diperlukan di dalam oven listrik:
CAO + 3C => CAC2 + BERSAMA
CAC2 Ini adalah kalsium karbida, senyawa anorganik yang akhirnya bereaksi dengan air untuk membentuk asetilena:
CAC2 + 2h2O => ca (OH)2 + HCHCHCH
Sifat fisik dan kimia alkine
Polaritas
Triple Link membedakan alkine dari alkans dan alkena. Tiga jenis hidrokarbon adalah apolar, tidak larut dalam air dan asam yang sangat lemah. Namun, elektronegativitas karbon ikatan ganda dan triple lebih besar dari karbon sederhana.
Menurut ini, karbon yang berdekatan dengan hasil ikatan rangkap tiga untuk efek induktif kepadatan beban negatif. Untuk alasan ini, di mana tautan CCEP atau C = C akan ada kepadatan elektronik yang lebih besar daripada di seluruh kerangka berkarbonasi. Akibatnya, ada momen dipol kecil di mana molekul berinteraksi dengan gaya dipol-dipolo.
Interaksi ini sangat lemah jika momen dipolnya dibandingkan dengan molekul air atau alkohol apa pun. Ini tercermin dalam sifat fisiknya: alkine umumnya memiliki titik fusi dan didih yang lebih tinggi dibandingkan dengan hidrokarbon mereka yang kurang tak jenuh.
Dapat melayani Anda: 7 aplikasi biokimia terpentingDemikian juga, karena polaritasnya yang rendah, mereka kurang tidak larut dalam air, tetapi larut dalam pelarut organik apolar, seperti benzena.
Keasaman
Juga, elektronegativitas ini menyebabkan hidrogen HC≡Cr lebih asam daripada siapa pun yang ada di hidrokarbon lainnya. Oleh karena itu, alkine adalah spesies lebih asam daripada alkena dan lebih dari alkana. Namun, keasamannya tetap tercela jika dibandingkan dengan asam karboksilat.
Karena alkine adalah asam yang sangat lemah, mereka hanya bereaksi dengan basa yang sangat kuat, seperti natrium amiduro:
HCHCR + NANH2 => HCHCNA + NH3
Dari reaksi ini, larutan natrium asetilur diperoleh, bahan baku untuk sintesis alkin lainnya.
Reaktivitas Alquinos
Reaktivitas alkin dijelaskan dengan penambahan molekul kecil ke triple link mereka, mengurangi ketidakjenuhannya. Ini bisa berupa molekul hidrogen, hidrogen hallogenides, air atau halogen.
Hidrogenasi
Molekul H kecil2 Ini sangat sulit dipahami dan cepat, jadi untuk meningkatkan peluang ditambahkan ke triple link alkines.
Ini biasanya logam (PD, PT, RH atau Ni) dibagi dengan halus untuk meningkatkan luas permukaan; Dan dengan cara ini, kontak antara hidrogen dan alquino:
Rcuarancr ' + 2h2 => Rch2Ch2R '
Hasilnya adalah hidrogen adalah "jangkar" untuk karbon memecahkan ikatan, dan seterusnya sampai alkana yang sesuai menghasilkan, RCH2Ch2R '. Ini tidak hanya jenuh hidrokarbon awal, tetapi juga memodifikasi struktur molekulnya.
Penambahan hidrogen halogenuros
Di sini molekul anorganik HX ditambahkan, di mana X dapat menjadi halogen (F, Cl, BR atau I):
Rcelajari ' + hx => rch = cxr'
Hidrasi
Hidrasi alkinus adalah ketika mereka menambahkan molekul air untuk membentuk aldehida atau keton:
Rcuarancr ' + h2O => rch2Kor '
Jika R 'adalah H, itu adalah aldehyde; Jika itu sewa, maka itu adalah cetona. Dalam reaksi senyawa yang dikenal sebagai enol (RCH = C (OH) R ') dibentuk sebagai perantara.
Ini menderita konversi bentuk enolik (c-oh) menjadi keton (c = o) dalam keseimbangan yang disebut tautomerisasi.
Penambahan halogen
Dan sehubungan dengan penambahan, molekul diatomik halogen juga dapat berlabuh ke karbon (x x2= F2, Cl2, Br2 saya dengar2):
Rc≡cr ' + 2x2 => Rcx2-Cx2R '
Alkilasi asetilena
Dari larutan natrium asetilur, alkine lain dapat disiapkan dengan menggunakan rental halide:
Hcuarancna + rx => hcuarancr + nax
Misalnya, jika itu adalah metil iodida, maka alkyne yang dihasilkan adalah:
HCHCNA + CH3I => hcuarancch3 + Nax
HCHCCH3 adalah yang tepat, juga dikenal sebagai Metilasetilen.
Struktur kimia alkine
 Struktur Kimia Alquino
Struktur Kimia Alquino Apa struktur alkin? Pada gambar atas molekul asetilena ditampilkan. Geometri linier dari tautan cop dapat jelas darinya.
Oleh karena itu, di mana ada ikatan rangkap tiga, struktur molekul harus linier. Ini adalah perbedaan penting antara mereka dan sisa hidrokarbon.
Ini dapat melayani Anda: Cycopropane (C3H6)Alkana biasanya direpresentasikan sebagai zig -zag, karena mereka memiliki hibridisasi SP3 dan tautannya dipisahkan 109º. Mereka sebenarnya adalah rantai tetrahedra yang bersatu secara kovalen. Sementara alkena datar oleh hibridisasi SP2 dari karbonnya, membentuk lebih khusus bidang trigonal dengan tautan terpisah sebesar 120º.
Dalam alkin, hibridisasi orbital adalah SP, yaitu, mereka memiliki 50% dari S dan 50% dari P. Ada dua orbital hibrida SP yang terkait dengan atom H pada kelompok asetilena atau alkyne di alkines.
Jarak H atau R adalah 180º, selain fakta bahwa hanya dengan cara ini orbital karbon murni dapat membentuk ikatan rangkap tiga. Karena alasan ini tautan -cop- linier. Melihat struktur molekul apa pun yang disorot -cop- di daerah -daerah di mana kerangka sangat linier.
Jarak dari tautan dan sedekah terminal
Karbon dalam ikatan triple berada pada jarak yang lebih kecil dari pada tautan ganda atau sederhana. Dengan kata lain, copc lebih pendek dari c = c dan c-c itu. Akibatnya, tautannya lebih kuat karena dua tautan π berkontribusi untuk menstabilkan tautan sederhana σ.
Jika ikatan rangkap tiga berada di akhir rantai, maka itu adalah terminal alkyne. Oleh karena itu, rumus senyawa tersebut harus hcuarancr, di mana H menyatakan akhir atau awal rantai.
Jika sebaliknya itu adalah tautan internal tiga, rumusnya adalah RCHCR ', di mana R dan R' adalah sisi kanan dan kiri rantai.
Nomenklatur Alquinos
Bagaimana alkine ditunjuk sesuai dengan aturan yang ditentukan oleh IUPAC? Dengan cara yang sama seperti Alkenos dan Alkena telah ditunjuk. Untuk melakukan ini, sufiks -ano atau -eno untuk akhiran -ino diubah.
Misalnya: hcuarancch3 Itu ditunjuk tips, karena memiliki tiga karbon, seperti propana (cho3Ch2Ch3). HCHCCH2Ch3 Itu adalah 1-butino, yang merupakan terminal alkyne. Tapi dalam kasus Cho3Celajaricch3 Ini adalah 2-butino, dan dalam hal ini tautan triple bukan terminal tetapi internal.
Ch3Celajaricch2Ch2(Ch3)2 Ini adalah 5-metil-2-heksin. Karbon dimulai dari sisi terdekat dengan triple link.
Jenis alkine lainnya adalah cycloalquins. Bagi mereka sudah cukup untuk menggantikan akhiran -ano oleh -ino dari sikloalcan yang sesuai. Dengan demikian siklopropan yang memiliki ikatan rangkap tiga dinamai siklopropin (yang tidak ada).
Ketika ada dua tautan tiga, awalan DI ditambahkan ke namanya-. Ini memiliki contoh untuk hcuaran-cop-cha, diacetylene atau propadine; Dan untuk HCHC-C-CCHH, Butadiino.
Penggunaan Alquinos
Asetilena atau etino
Yang terkecil dari alkin mengental jumlah kemungkinan kegunaan untuk hidrokarbon ini. Dari sana melalui alks, senyawa organik lainnya dapat disintesis. Ini juga mengalami reaksi oksidatif untuk mendapatkan etanol, asam asetat, asam akrilik, antara lain.
Dapat melayani Anda: lithium hydride: struktur, sifat, mendapatkan, menggunakanPenggunaannya yang lain terdiri dari menyediakan sumber panas untuk menggairahkan elektron atom; Lebih spesifik, E kation logam dalam penentuan dengan emisi penyerapan atom, teknik spektroskopi yang banyak digunakan.
Alkines alami
Satu -satunya metode yang ada untuk menyiapkan alkin tidak hanya sintetis atau dengan aplikasi panas tanpa adanya oksigen, tetapi juga biologis.
Dalam enzim ini disebut asetil, yang dapat menyangkal ikatan rangkap. Berkat ini, banyak sumber alkin alami yang tercapai.
Setelah ini, sumber -sumber ini dapat diekstraksi racun, penangkal, obat -obatan atau senyawa lain yang memberikan manfaat apa pun; Terutama saat itu menyangkut kesehatan. Alternatifnya banyak saat memodifikasi struktur aslinya dan menjadikannya sebagai dukungan untuk alkin baru.
Contoh alkin
Sejauh ini banyak contoh alkine telah disebutkan. Namun, beberapa berasal dari sumber yang sangat spesifik atau memiliki struktur molekul tertentu: mereka adalah poliasetyle.
Ini berarti bahwa mungkin ada lebih dari triple link yang merupakan bagian dari struktur yang sangat besar, dan tidak hanya dari rantai berkarbonasi sederhana.
Asam Tariric
 Struktur asam taryric
Struktur asam taryric Asam Tariric berasal dari tanaman yang terletak di Guatemala yang disebut Picramnia Tariri. Itu secara khusus diekstraksi dari minyak dari bijinya.
Dalam struktur molekulnya, tautan triple tunggal dapat diamati yang memisahkan ekor apolar dari kepala kutub; Oleh karena itu dapat dianggap sebagai molekul amfipatic.
Histrionicotoxin
 Struktur histrionicotoxin
Struktur histrionicotoxin Histrionicotoxin adalah racun yang dipisahkan oleh kulit penduduk Kolombia, Brasil dan negara -negara Amerika Latin lainnya. Ini memiliki dua tautan terkonjugasi tiga dengan ikatan rangkap. Keduanya adalah terminal dan dipisahkan oleh cincin enam -karbon dan amina siklus.
Cicutoxin
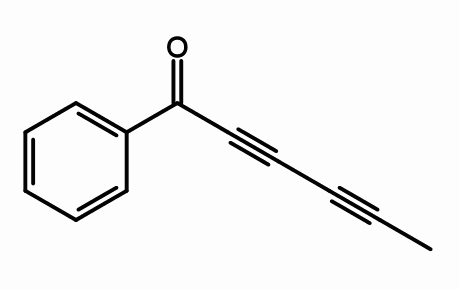 Struktur cicutoxin. Oleh giorgioGp2 [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0) atau gfdl (http: // www.gnu.Org/copyleft/fdl.html)], dari Wikimedia Commons
Struktur cicutoxin. Oleh giorgioGp2 [cc by-sa 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0) atau gfdl (http: // www.gnu.Org/copyleft/fdl.html)], dari Wikimedia Commons Dari struktur molekul cicutoxin, di mana link triple? Jika ikatan rangkap rata, karena terlihat benar, dan tautan sederhananya adalah tetrahedral, seperti pada ujungnya, tiga kali lipat linier dan berada di lereng (\).
Senyawa ini terdiri dari neurotoksin yang ditemukan terutama di tanaman penyembuhan air.
Capillina
 Struktur Capillina. Oleh KLEVER [CC0], dari Wikimedia Commons
Struktur Capillina. Oleh KLEVER [CC0], dari Wikimedia Commons Ini adalah alkyne yang hadir dalam minyak esensial tanaman Artemis yang digunakan sebagai agen antijamur. Dua tautan tiga kali lipat berturut -turut dapat diamati, lebih tepatnya terkonjugasi.
Apa artinya? Bahwa ikatan triple beresonansi di sepanjang rantai karbon dan melibatkan bahwa ikatan rangkap C = O dibuka ke C-O-.
Pargilin
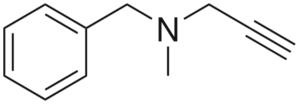 Struktur Pargilin
Struktur Pargilin Itu adalah aktivitas antihipertensi. Menganalisis strukturnya di beberapa bagian adalah: kelompok benchilo di sebelah kiri, amina tersier di tengah, dan sayap kanan; yaitu kelompok properti terminal.
Referensi
- Francis a. Tortoiseshell. Kimia organik. Asam karboksilat. (Edisi Keenam., Halaman 368-397). MC Graw Hill.
- Brennan, John. (10 Maret 2018). Contoh alkin. Ilmu pengetahuan. Diambil dari: Ilmu Pengetahuan.com
- BYJU. (2018). Bond Triple di Alkynes. Diambil dari: byjus.com
- Encyclopedia of Contoh (2017). Alkynes. Pulih dari: contoh.bersama
- Kevin a. Boudreaux. Alkynes. Diambil dari: Angelo.Edu
- Robert C. Neuman, jr. Alkena dan alkynes. [PDF]. Diambil dari: chem.UCR.Edu

