Sejarah belerang, sifat, struktur, memperoleh, menggunakan

- 3660
- 637
- Jessie Harvey
Dia sulfur Ini adalah elemen non -logam yang mengarah, di bawah oksigen, kelompok kalkogen dalam tabel periodik. Secara khusus terletak di grup 16 dengan periode 3, dan diwakili dengan simbol kimia s. Dari isotop alami, 32S tertidur banyak (sekitar 94% dari semua atom belerang).
Ini adalah salah satu elemen paling berlimpah di Bumi, menyusun sekitar 3% dari total massa. Artinya jika semua sulfur planet ini diambil, dua bulan kuning dapat dibangun; akan ada tiga satelit, bukan satu. Itu dapat mengadopsi beberapa keadaan oksidasi (+2, -2, +4 dan +6), sehingga garamnya banyak dan memperkaya korteks dan nukleus terestrial.
 Kristal belerang. Sumber: Pixabay.
Kristal belerang. Sumber: Pixabay. Sulfur identik dengan kuning, bau buruk dan neraka. Alasan utama bau buruknya adalah karena senyawa yang diturunkan; terutama gas dan organik. Sisanya, mineral mereka solid dan memiliki warna yang termasuk kuning, abu -abu, hitam dan putih (antara lain).
Itu adalah salah satu elemen yang paling banyak menghadirkan sejumlah besar alotrop. Itu dapat ditemukan sebagai molekul S kecil dan bijaksana2 atau s3; Sebagai cincin atau siklus, menjadi ortorombik dan belerang monoklinik8 yang paling stabil dan berlimpah dari semuanya; dan sebagai rantai heliks.
Tidak hanya ditemukan di korteks darat dalam bentuk mineral, tetapi juga dalam matriks biologis tubuh kita. Sebagai contoh, itu adalah asam amino sistin, sistein dan metionin, dalam protein zat besi, keratin dan vitamin. Ini juga hadir dalam bawang putih, grapefruits, bawang, kubis, brokoli dan cauliflor.
Secara kimia itu adalah elemen lunak, dan tanpa adanya oksigen membentuk mineral sulfuro dan sulfat. Terbakar dengan api kebiruan dan dapat ditampilkan sebagai padatan amorf atau kristal.
Meskipun sangat diperlukan untuk sintesis asam sulfat, zat yang sangat korosif, dan memberikan bau yang tidak menyenangkan, itu sebenarnya adalah elemen jinak. Belerang dapat disimpan di ruang apa pun tanpa tindakan pencegahan besar, selama kebakaran dihindari.
[TOC]
Sejarah Sulfur
Dalam Alkitab
Belerang adalah salah satu elemen tertua dalam sejarah kemanusiaan; Sedemikian rupa sehingga penemuannya tidak pasti dan tidak diketahui peradaban kuno mana yang menggunakannya untuk pertama kalinya (4000 tahun sebelum Kristus). Di halaman Alkitab yang sama Anda dapat menemukannya menyertai api infernal dan kerusakan.
Dipercayai bahwa dugaan bau neraka berkaitan dengan letusan gunung berapi. Penemu pertamanya pasti akan bertemu dengan tambang elemen ini sebagai debu atau kristal kuning di sekitar gunung berapi.
Jaman dahulu
Padatan kekuningan ini segera menunjukkan efek penyembuhan yang penting. Misalnya, orang Mesir menggunakan belerang untuk mengobati radang kelopak mata. Ini juga melonggarkan kudis dan jerawat, aplikasi yang hari ini dapat dilihat pada sabun belerang dan barang -barang dermatologis lainnya.
Bangsa Romawi menggunakan elemen ini dalam ritual mereka, seperti fumigante dan pemutih. Saat Librara Sos2, gas yang membanjiri kamar bercampur dengan kelembaban dan menyediakan media antibakteri dan mampu memusnahkan serangga.
Orang -orang Romawi, seperti orang -orang Yunani, menemukan sulfur yang mudah terbakar, jadi menjadi identik dengan api. Warna api kebiruannya harus menerangi sirkus Romawi. Dipercayai bahwa orang -orang Yunani, sementara itu, menggunakan elemen ini untuk membuat senjata pembakar.
Orang Cina di pihak mereka belajar bahwa mencampur belerang dengan Saltpeter (Kno3) dan batubara menciptakan bubuk mesiu hitam yang membayar omset bersejarah, dan yang terangsang di negara -negara dari tuntutan dan minat besar pada mineral ini.
Itu dapat melayani Anda: Circonium: Sejarah, sifat, struktur, risiko, penggunaanZaman modern
Seolah -olah bubuk mesiu bukanlah alasan yang cukup untuk mengingini sulfur, asam sulfat dan aplikasi industri segera muncul. Dan dengan tongkat asam sulfat, jumlah kekayaan atau kemakmuran suatu negara dalam kaitannya dengan tingkat konsumsi senyawa ini diukur.
Baru pada tahun 1789 ketika ahli kimia yang brilian Antoine Lavoisier mampu mengenali belerang dan mengklasifikasikannya sebagai elemen. Kemudian, pada tahun 1823 ahli kimia Jerman Eilhard Mitscherlich menemukan bahwa sulfur sebagian besar dapat mengkristal dalam dua cara: rhomboédrica dan monoklinik.
Sejarah belerang mengikuti saluran senyawa dan aplikasinya yang sama. Dengan kepentingan industri yang sangat besar dari asam sulfat, ia menemani vulkanisasi karet, sintesis penisilin, eksploitasi pertambangan, pemurnian sulfur -minyak mentah yang lebih kaya, nutrisi tanah, dll.
Properti
Penampilan fisik
Angin kencang dalam debu atau kristal. Warnanya berwarna kuning lemon buram, rasanya hambar dan tidak memiliki bau.
Penampilan cair
Sulfur cair adalah singular karena warna kuning awalnya menjadi kemerahan dan meningkat dan semakin gelap jika mengalami suhu tinggi. Saat terbakar, ucapkan api biru dan cerah.
Masa molar
32 g/mol.
Titik lebur
115.21ºC.
Titik didih
445ºC.
titik pengapian
160ºC.
Suhu diri sendiri
232ºC.
Kepadatan
2.1 g/ml. Namun, alotrop lain bisa kurang padat.
Kapasitas panas molar
22.75 j/mol · k
Kovalen radio
105 ± 3 sore.
Elektronegativitas
2.58 pada skala Pauling.
Polaritas
Tautan S-S adalah apolar karena kedua atom belerang memiliki elektronegativitas yang sama. Ini membuat semua alotropnya, siklus atau dalam bentuk rantai, menjadi apolar; Dan oleh karena itu, interaksinya dengan air tidak efisien dan tidak dapat dilarutkan di dalamnya.
Namun, belerang dapat dilarutkan dalam pelarut apolar seperti karbon disulfida, CS2, dan aromatik (benzena, toluena, xylene, dll.).
Ion
Belerang dapat membentuk beberapa ion, umumnya anion. Yang paling terkenal dari semuanya adalah sulfida, s2-. S2- Ini ditandai dengan menjadi besar dan basis Lewis yang lembut.
Untuk menjadi basis lunak, teori ini menetapkan bahwa ia akan cenderung membentuk senyawa dengan asam lunak; Seperti kation logam transisi, termasuk iman2+, Pb2+ dan cu2+.
Struktur dan konfigurasi elektronik
Mahkota belerang
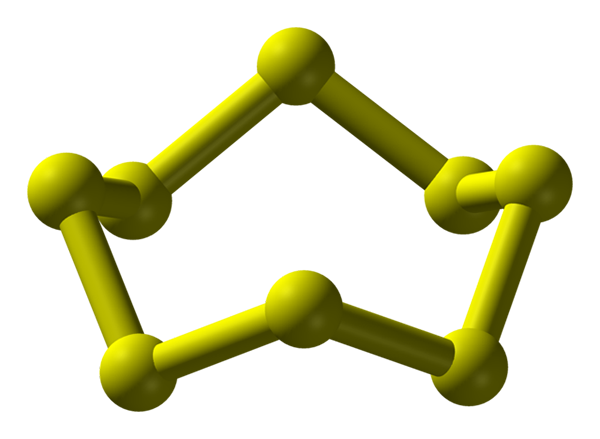 Molekul S8, alotropik belerang yang paling stabil dan berlimpah. Sumber: Benjah-BMM27.
Molekul S8, alotropik belerang yang paling stabil dan berlimpah. Sumber: Benjah-BMM27. Belerang dapat terjadi dalam berbagai macam alotrop; dan ini pada gilirannya memiliki struktur kristal yang dimodifikasi di bawah tekanan dan/atau suhu yang berbeda. Oleh karena itu, sulfur adalah elemen yang kaya dalam alotropo dan polimorf, dan studi tentang struktur padatnya merupakan sumber yang tak ada habisnya dari karya eksperimental teoretis.
Mengapa kompleksitas struktural seperti itu? Untuk mulai dengan, ikatan kovalen dalam sulfur (S-S) sangat kuat, diatasi hanya oleh karbon, C-C, dan oleh hidrogen, H-H.
Sulfur, tidak seperti karbon, tidak cenderung membentuk tetrahedra tetapi bumerang; bahwa dengan sudut mereka melipat dan berdering untuk menstabilkan rantai belerang. Cincin yang paling terkenal dari semuanya, juga mewakili alotropik sulfur yang paling stabil, adalah s8, "Mahkota belerang" (gambar yang lebih tinggi).
Perhatikan bahwa semua tautan S-S8 Mereka tampak bumerang individu, menghasilkan cincin dengan lipatan dan datar sama sekali. Mahkota ini s8 Mereka berinteraksi melalui pasukan London, berorientasi sedemikian rupa sehingga mereka berhasil menciptakan pola struktural yang mendefinisikan kristal ortorombik; disebut s8 α (S-α, atau hanya sulfur ortorombik).
Dapat melayani Anda: bahan elastisPolimorf
Mahkota belerang adalah salah satu dari banyak alotrop untuk elemen ini. S8 α adalah polimorf dari mahkota ini. Ada dua lainnya (di antara yang paling penting) yang disebut s8 β dan s8 γ (S-β dan S-γ, masing-masing). Kedua polimorf mengkristal dalam struktur monoklinik, menjadi S8 γ lebih padat (sulfur gamma).
Ketiganya adalah padatan kuning. Tetapi bagaimana setiap polimorf diperoleh secara terpisah?
S8 β mempersiapkan s8 α pada 93 ° C, kemudian membiarkan pendinginan lambatnya memperlambat transisi pengembaliannya ke fase ortorombik (α). Dan s8 γ, di sisi lain, diperoleh saat didasarkan8 α pada 150 ° C, memungkinkan lagi menjadi dingin secara perlahan; Itu adalah polimorf mahkota sulfur terpadat.
Alotrop siklik lainnya
Mahkota s8 Itu bukan satu -satunya alotrop siklik. Ada yang lain seperti s4, S5 (Analog dengan siklopentano), s6 (diwakili oleh segi enam dan juga siklus), s7, S9, dan S10-20; Yang terakhir berarti bahwa mungkin ada cincin atau siklus yang mengandung sepuluh hingga dua puluh atom belerang.
Masing -masing mewakili berbagai siklik belerang yang berbeda; Dan pada gilirannya, untuk menekankannya, mereka memiliki varietas polimorf atau struktur polimorfik yang bergantung pada tekanan dan suhu.
Misalnya, S7 Ini memiliki hingga empat polimorf yang diketahui: α, β, γ, dan δ. Anggota atau mahkota dari massa molekul yang lebih tinggi adalah produk sintesis organik dan tidak mendominasi sifatnya.
Rantai belerang
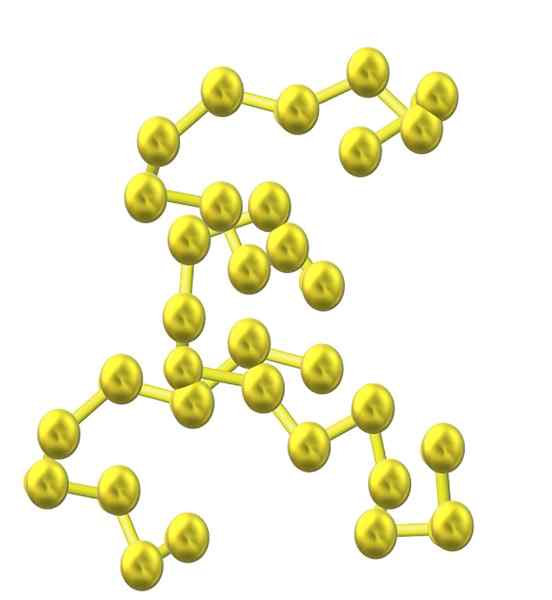 Rantai belerang. Sumber: Opentax [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)]
Rantai belerang. Sumber: Opentax [CC oleh 4.0 (https: // createveCommons.Org/lisensi/oleh/4.0)] Karena lebih banyak atom sulfur dimasukkan ke dalam struktur, kecenderungannya berkurang dan rantai sulfur tetap terbuka dan mengadopsi konformasi heliks (seolah -olah mereka adalah spiral atau sekrup).
Dan dengan demikian, keluarga belerang yang banyak dari banyak sulfur muncul yang tidak terdiri dari cincin atau siklus tetapi rantai (seperti gambar superior).
Ketika rantai S-S ini sejajar secara paralel dengan kaca, mereka menangkap kotoran dan akhirnya mendefinisikan padatan berserat yang disebut sulfur berserat, atau S-ψ. Jika di antara rantai paralel ini ada ikatan kovalen yang menghubungkannya (seperti halnya vulkanisasi karet), kami memiliki sulfur laminar.
Saat belerang s8 Itu melelehkan fase cair kekuningan yang bisa menjadi gelap jika suhunya meningkat. Ini karena tautan S-S rusak, dan karenanya terjadi proses depolimerisasi termal.
Cairan ini saat dingin menunjukkan karakteristik plastik dan kemudian kaca; yaitu, sulfur vitreous dan amorf (s-we) diperoleh. Komposisinya terdiri dari kedua cincin dan rantai belerang.
Dan ketika campuran alotrop fibrosa dan laminar diperoleh dari belerang amorf, produk komersial yang digunakan untuk vulkanisasi karet.
Alotrop kecil
Meskipun mereka dibiarkan terakhir, mereka tidak kalah penting (atau menarik) daripada alotropo dari massa molekul terbesar. S2 dan S3 adalah versi o yang tersulfurisasi2 SAYA3. Dalam dua atom sulfur pertama, mereka bergabung dengan ikatan rangkap, S = S, dan di kedua ada tiga atom dengan struktur resonansi, S = S-S.
Keduanya s2 seperti s3 Mereka gas. S3 Mewujudkan warna merah ceri. Keduanya memiliki bahan bibliografi yang cukup untuk masing -masing mencakup artikel individual.
Konfigurasi elektronik
Konfigurasi elektronik untuk atom belerang adalah:
[Ne] 3s2 3p4
Anda bisa mendapatkan dua elektron untuk menyelesaikan Octeto of Valencia Anda, dan dengan demikian memiliki keadaan oksidasi -2. Demikian juga, Anda dapat kehilangan elektron, dimulai dengan dua dalam orbital 3p, menjadi keadaan oksidasi +2; Jika Anda kehilangan dua elektron lagi, dengan orbital 3p kosong Anda, status oksidasi Anda akan +4; Dan jika Anda kehilangan semua elektron, itu akan menjadi +6.
Dapat melayani Anda: metaloidMendapatkan di mana belerang?
Mineralogi
Belerang adalah bagian dari banyak mineral. Di antara mereka adalah pirit (fes2), La galena (PBS), covellita (cus), dan mineral sulfat dan sulfida lainnya. Dengan memprosesnya, tidak hanya logam yang dapat diekstraksi, tetapi juga belerang setelah serangkaian reaksi reduktif.
Ini juga dapat diperoleh murni dalam ventilasi vulkanik, di mana ketika suhu dinaikkan dan tumpah menurun; Dan jika dia membakar, dia akan terlihat seperti lava kebiruan. Melalui pekerjaan yang sulit, dan pekerjaan fisik yang berat, belerang dapat dikumpulkan seperti yang dilakukan cukup sering di Sisilia.
Belerang juga dapat ditemukan di tambang bawah tanah, yang dibuat untuk memompa air terlalu panas untuk meleleh dan mentransfernya ke permukaan. Proses perolehan ini dikenal sebagai proses Brasch, saat ini sedikit digunakan.
Minyak bumi
Saat ini sebagian besar belerang berasal dari industri minyak, karena senyawa organiknya adalah bagian dari komposisi minyak mentah minyak dan turunannya yang halus.
Jika mentah atau produk yang disempurnakan kaya akan belerang dan mengalami hidrodesulfurisasi, itu akan melepaskan sejumlah besar H2S (gas bau yang berbau seperti telur busuk):
R-S-R + 2 H2 → 2 RH + H2S
Lalu h2S secara kimiawi dalam proses Clauss, dirangkum dengan persamaan kimia berikut:
3 o2 + 2 h2S → 2 Jadi2 + 2 h2SALAH SATU
Sw2 + 2 h2S → 3 S + 2 H2SALAH SATU
Aplikasi
Beberapa kegunaan untuk belerang disebutkan di bawah ini dan secara umum:
- Ini adalah elemen penting untuk tanaman dan hewan. Bahkan hadir dalam dua asam amino: sistein dan metode.
- Ini adalah bahan baku untuk asam sulfat, disusun dalam persiapan produk komersial yang tak terhitung banyaknya.
- Dalam industri farmasi ini dimaksudkan untuk sintesis turunan belerang, penisilin menjadi yang paling terkenal dari contoh -contohnya.
- Memungkinkan vulkanisasi karet dengan menghubungkan rantai polimer dengan tautan S-s.
- Warna kuning dan campurannya dengan logam lain membuatnya diinginkan di industri pigmen.
- Dicampur dengan matriks anorganik, seperti pasir dan batu, beton dan aspal sulfur disiapkan untuk penggantian bitumen.
Risiko dan tindakan pencegahan
Sulfur sendiri adalah zat yang tidak berbahaya dan tidak beracun dan juga mewakili risiko potensial, kecuali bereaksi untuk membentuk senyawa lain. Garam sulfatnya tidak berbahaya dan dapat dimanipulasi tanpa tindakan pencegahan besar. Namun, ini tidak terjadi dengan turunan gasnya: jadi2 dan H2S, keduanya sangat beracun.
Jika dalam fase cair dapat menyebabkan luka bakar yang serius. Jika menelan dalam jumlah besar, H dapat memicu2S di usus. Selebihnya, itu tidak mewakili risiko apa pun bagi mereka yang mengunyah.
Secara umum sulfur adalah elemen pasti yang tidak memerlukan terlalu banyak tindakan pencegahan, kecuali menjauhkannya dari api dan agen pengoksidasi yang kuat.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Laura Crapanzano. (2006). Polimorfisme Sulfur: Aspek Struktural dan Dinamis. Fisika [Fisika].University Joseph -Fourier - Grenoble I. Bahasa inggris. FFTEL-00204149F
- Wikipedia. (2019). Alotrop sulfur. Diperoleh dari: di.Wikipedia.org
- Meyer Beat. (1976). Belerang dasar. Ulasan Kimia, Vol. 76, no. 3.
- Kata. Doug Stewart. (2019). Fakta Elemen Sulfur. Chemicool. Pulih dari: chemicool.com
- Donald w. Davis dan Randall A. Detro. (2015). Sejarah belerang. Georgia Gulf Sulphur Corporation. Pulih dari: georgiagulfsulfur.com
- Helmestine, Anne Marie, PH.D. (11 Januari 2019). 10 fakta belerang yang menarik. Pulih dari: thinkco.com
- Boone, c.; Bond, c.; Hallman, a.; Jenkins, J. (2017). Lembar fakta umum belerang; Pusat Informasi Pestisida Nasional, Layanan Penyuluhan Universitas Negeri Oregon. Npic.Orst.Edu
- « Kemandirian dari Penyebab Meksiko, Pengembangan, Konsekuensi, Karakter
- Flora dan fauna spesies perwakilan Jalisco »

