Sejarah Boro, Properti, Struktur, Penggunaan

- 4635
- 352
- Irvin Reichel
Dia Boron Ini adalah elemen non -metalik yang mengepalai kelompok 13 dari tabel periodik dan diwakili dengan simbol kimia b. Nomor atomnya adalah 5, dan merupakan satu -satunya elemen non -metallic dalam kelompoknya; Meskipun beberapa bahan kimia menganggapnya sebagai metaloid.
Itu disajikan sebagai bubuk coklat kehitaman, dan dalam proporsi 10 ppm sehubungan dengan kerak bumi. Oleh karena itu bukan salah satu elemen yang paling melimpah.
 Sampel boro dengan kemurnian sekitar 99%. Sumber: Alajhasha [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Sampel boro dengan kemurnian sekitar 99%. Sumber: Alajhasha [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Ini adalah bagian dari beberapa mineral seperti boraks atau natrium borat, ini adalah mineral boron yang paling umum. Ada juga Kurnite, bentuk lain dari natrium borerate; Colemanite atau kalsium borat; dan ulexite, natrium dan kalsium borato.
Boratos diekstraksi di Amerika Serikat, Tibet, Cina dan Chili dengan produksi dunia sekitar dua juta ton per tahun.
Elemen ini memiliki tiga belas isotop, menjadi yang paling berlimpah sebelasB, yang merupakan 80,1% dari boron, dan 10B, yang membentuk 19,9% sisanya.
Boron adalah jejak penting untuk tanaman, campur tangan dalam sintesis beberapa protein tanaman vital dan berkontribusi terhadap penyerapan air. Pada mamalia tampaknya perlu untuk kesehatan tulang.
Meskipun boron ditemukan pada tahun 1808 oleh ahli kimia Inggris Sir Humphry Davy, dan ahli kimia Prancis Jacques Thérnard dan Joseph Gay-Lussac, sejak awal era kami di Cina digunakan Boraks dalam penjabaran tembikar enamel enamel kami.
Boron dan senyawanya memiliki banyak kegunaan dan aplikasi, mulai dari penggunaannya dalam konservasi makanan, terutama margarin dan ikan, sampai digunakan dalam pengobatan tumor kanker otak, kandung kemih, prostat dan organ lain dan organ lain dan organ lainnya.
Boron tidak terlalu larut dalam air, tetapi senyawanya. Ini bisa menjadi mekanisme konsentrasi boron, serta sumber keracunan dengan elemen.
[TOC]
Sejarah
Latar belakang
Sejak Remote Times Man telah menggunakan senyawa boron dalam berbagai kegiatan. El Borax, mineral yang dikenal sebagai Tincal, digunakan di Cina pada tahun 300 hari.C. dalam elaborasi keramik enamel.
Alkemis Persia (865-925) membuat sebutan pertama senyawa boro. Rhazes mengklasifikasikan mineral dalam enam kelas, salah satunya adalah borosi yang termasuk boron.
Agricola, sekitar tahun 1600, melaporkan penggunaan boraks sebagai aliran metalurgi. Pada 1777, keberadaan asam borat dalam arus air panas di dekat Florence diakui.
Penemuan elemen
Humphry Davy, melalui elektrolisis larutan boraks, mengamati akumulasi endapan hitam di salah satu elektroda. Dia juga menghangatkan boron oksida (b2SALAH SATU3) Dengan kalium, menghasilkan bubuk coklat kehitaman yang merupakan bentuk boron yang diketahui.
Gay-Lussac dan Thénard mengurangi asam borat pada suhu tinggi di hadapan zat besi untuk menghasilkan boron. Mereka juga menunjukkan proses sebaliknya, yaitu, di mana asam borat adalah produk dari oksidasi boron.
Identifikasi dan isolasi
Jöns Jakob Berzelius (1827) mencapai identifikasi Boro sebagai elemen baru. Pada tahun 1892, ahli kimia Prancis Henri Moissan berhasil memproduksi boron dengan kemurnian 98%. Meskipun, ditunjukkan bahwa boron diproduksi murni oleh ahli kimia Amerika Yehezkiel Weintraub, pada tahun 1909.
Properti
Deskripsi Fisik
Bubuk amorf padat atau coklat hitam.
Dapat melayani Anda: peroksida: properti, nomenklatur, penggunaan, contohMasa molar
10.821 g/mol.
Titik lebur
2076 ºC.
Titik didih
3927 ºC.
Kepadatan
-Cairan: 2.08 g/cm3.
-Kristal dan amorf pada 20 ºC: 2,34 g/cm3.
Panas fusi
50,2 kJ/mol.
Panas penguapan
508 kJ/mol.
Kapasitas kalori molar
sebelas.087 J/(mol · k)
Energi ionisasi
-Level Pertama: 800.6 kJ/mol.
-Level Kedua: 2.427 kJ/mol.
-Level ketiga: 3.659,7 kJ/mol.
Elektronegativitas
2.04 pada skala Pauling.
Radio atom
90 PM (empiris).
Volume atom
4.16 cm3/mol.
Konduktivitas termal
27.4 w/m.K
Resistivitas listrik
~ 106 Ω.M (pada 20ºC).
Boron suhu tinggi adalah konduktor listrik yang baik, tetapi pada suhu sekitar itu menjadi hampir sebuah isolator.
Kekerasan
~ 9,5 pada skala Mohs.
Reaktivitas
Boron tidak terpengaruh oleh asam klorida pada suhu mendidih. Namun, itu dikonversi oleh asam nitrat panas menjadi asam borat (h3Bo3). Boro secara kimia berperilaku seperti non -logam.
Bereaksi dengan semua halogen untuk memberikan trihaluro, sangat reaktif. Ini memiliki formula umum bx3, Dimana x mewakili halogen.
Itu dikombinasikan dengan beberapa elemen untuk berasal dari boruros. Beberapa dari mereka adalah di antara zat kekerasan yang lebih besar; Misalnya, Boron Nitride (BN). Boron dikombinasikan dengan oksigen untuk membentuk boron trioksida.
Struktur dan konfigurasi boron elektronik
Tautan dan unit struktural di boron
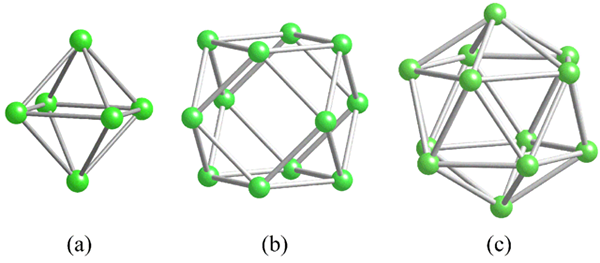 Geometri unit struktural umum untuk boron. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Geometri unit struktural umum untuk boron. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Sebelum mengatasi struktur boron (kristal atau amorf), penting untuk mengingat bagaimana atom mereka dapat dihubungkan. Tautan B-B adalah dalam esensi kovalen; Bukan hanya itu, tetapi karena atom boro secara alami memiliki kekurangan elektronik, mereka akan mencoba memasoknya di tautan mereka dengan satu atau lain cara.
Di boron ada jenis ikatan kovalen khusus: yaitu tiga pusat dan dua elektron, 3c2e. Di sini tiga atom boron berbagi dua elektron, dan mendefinisikan segitiga, salah satu dari banyak wajah yang ditemukan dalam polyhedros struktural mereka (gambar superior).
Dari kiri ke kanan yang kita miliki: octaedro (a, b6), Cuboctaedro (b, b12), Dan isocasedro (c, b12 Juga). Semua unit ini berbagi fitur: mereka buruk dalam elektron. Karena itu, mereka harus menghubungkan secara kovalen di antara mereka sendiri; Dan hasilnya adalah pesta tautan yang mengejutkan.
Di setiap segitiga polyhedros ini, tautan 3C2E hadir. Kalau tidak, tidak dapat dijelaskan bagaimana boron, mampu membentuk hanya tiga ikatan kovalen sesuai dengan teori Link Valencia, dapat memiliki hingga lima tautan dalam unit polyhedral ini.
Struktur boron kemudian terdiri dari pengaturan dan pengulangan unit -unit ini yang akhirnya mendefinisikan kristal (atau padatan amorf).
Boro α-romboédrico
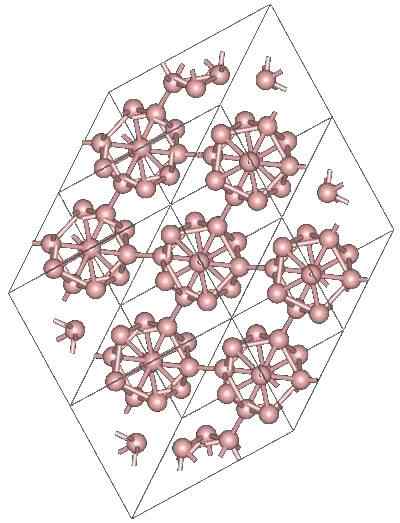 Struktur kristal dari α-romboédrico boron alotropik. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur kristal dari α-romboédrico boron alotropik. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Mungkin ada unit polihedral lain dari Boro, serta senyawa hanya oleh dua atom, b2; "Garis" boron yang harus dikaitkan dengan atom lain yang mengikuti kekurangan elektronik yang tinggi.
Icosaedro sejauh ini merupakan kesatuan boron yang disukai; Yang terasa lebih baik. Di gambar atas, misalnya, dihargai bagaimana unit B ini12 Mereka terjalin untuk mendefinisikan kristal rhombohedral boron-α.
Jika salah satu icosaedros itu ingin diisolasi, itu akan menjadi tugas yang rumit, karena kekurangan elektronik mereka memaksa mereka untuk mendefinisikan kristal di mana masing -masing menyediakan elektron yang dibutuhkan tetangga lain.
Β-romboédrico boron
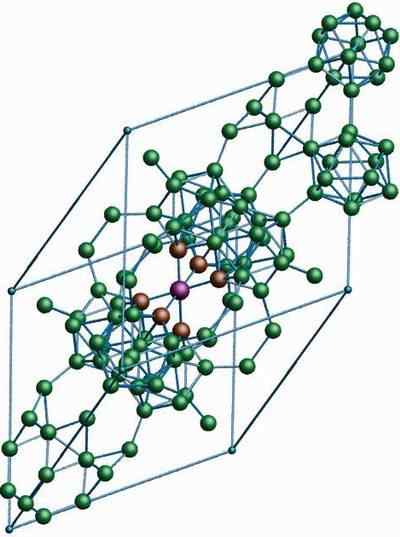 Struktur kristal β-romboédrico boron alotropik. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur kristal β-romboédrico boron alotropik. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Β-romboédrico boron alotropik, seperti namanya, memiliki kristal rhomboédica serta boron-α; Namun, itu berbeda dalam unit strukturalnya. Sepertinya kapal luar angkasa yang dibuat dengan atom boron.
Itu dapat melayani Anda: lithium hidroksida (lioh)Jika Anda dapat dengan hati -hati melihat unit icosahedrik dengan cara yang bijaksana dan digabungkan (di tengah). Ada juga unit B10 dan atom boron kesepian yang bertindak sebagai jembatan untuk unit yang disebutkan di atas. Dari semua itu, ini adalah alotrop boron paling stabil.
Boro-γ Gema
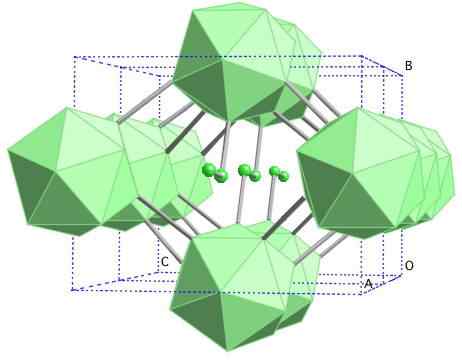 Struktur kristal boron-γ. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur kristal boron-γ. Sumber: MaterialScientist at English Wikipedia [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Dalam Alotrop Boron ini, unit B dikoordinasikan2 dan B12. B2 menyajikan begitu banyak defisiensi elektronik yang sebenarnya menghilangkan elektron dari b12 Dan karena itu, ada karakter ionik dalam padatan ini. Yaitu, mereka tidak hanya bersatu secara kovalen, tetapi ada jenis daya tarik elektrostatik [b2-] [B12+].
Boro-γ mengkristal dalam struktur garam GEMA, sama seperti untuk NaCl. Alotrop lainnya dari boron ke tekanan tinggi (20 GPa) dan suhu (1800 ° C) diperoleh, dan kemudian tetap stabil dalam kondisi normal. Stabilitas faktualnya bersaing dengan β-romboédrico boron.
Kubik dan amorf
Alotrop boron lainnya terdiri dari agregat atom B seolah -olah mereka disatukan oleh ikatan logam, atau seolah -olah mereka adalah kristal ionik; Artinya, itu adalah boron kubik.
Juga, dan paling tidak, adalah boron amorf, yang disposisi unit B12 Itu acak dan berantakan. Itu disajikan sebagai bubuk warna gelap atau kaca dan coklat buram.
Borofenos
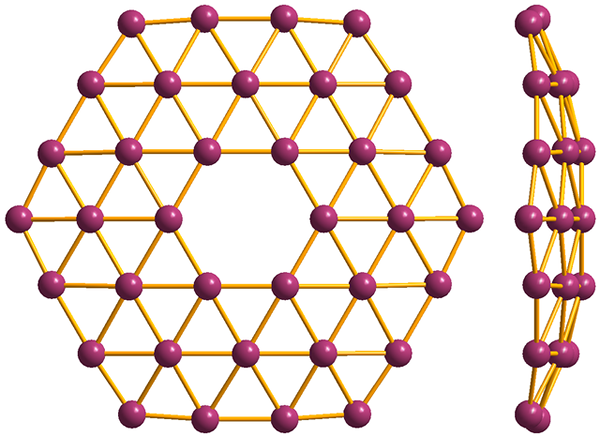 Struktur yang paling sederhana dari Borofenos, B36. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Struktur yang paling sederhana dari Borofenos, B36. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Dan akhirnya adalah alotropik Boro: Borofenos (gambar yang lebih tinggi) yang paling aneh). Ini terdiri dari lapisan monyet atom boron; sangat tipis dan analog dengan graphene. Perhatikan bahwa ia mempertahankan segitiga yang terkenal, karakteristik kekurangan elektronik yang menderita atom -atomnya.
Selain borofeno, yang b36 Ini adalah yang paling sederhana dan kecil, ada juga kelompok Boro. Borosferene (gambar di bawah) terdiri dari kandang bola yang mirip dengan bola empat puluh atom Boro, b40; Tetapi alih -alih memiliki tepi yang halus, mereka tiba -tiba dan tidak teratur:
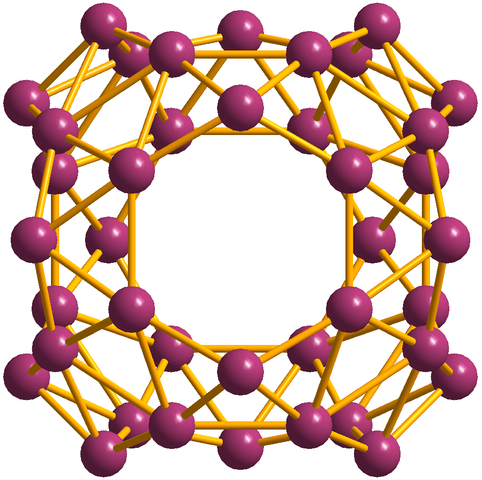 Unit Borosferenos, B40. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Unit Borosferenos, B40. Sumber: MaterialScientist [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Konfigurasi elektronik
Konfigurasi elektronik boron adalah:
[Dia] 2s2 2 p1
Oleh karena itu, tiga elektron dari Valencia. Dia kekurangan lima lagi untuk menyelesaikan Octeto of Valencia, dan dia hampir tidak dapat membentuk tiga ikatan kovalen; Saya akan membutuhkan tautan datif keempat untuk menyelesaikan oktet Anda. Boron dapat kehilangan tiga elektronnya untuk memperoleh keadaan oksidasi +3.
Memperoleh
Boron diisolasi dengan mengurangi asam borat dengan magnesium atau aluminium; Metode mirip dengan Gay-Lussac dan Thénard. Itu mengalami kesulitan polusi boron dengan boruro logam -logam itu.
Sampel kemurnian tinggi dapat diperoleh dengan reduksi gas boron triklorida, atau tribromide, dengan hidrogen pada filamen yang dipanaskan secara elektrik.
Boron kemurnian tinggi disiapkan dengan dekomposisi pada suhu diborano tinggi, diikuti oleh pemurnian dengan fusi zona atau proses czocharalski.
Aplikasi
Di industri
Boron unsur telah digunakan dalam pengerasan baja. Dalam paduan dengan besi yang mengandung boron antara 0,001 dan 0,005 %. Ini juga digunakan dalam industri non -jantan, biasanya sebagai deoksidan.
Selain itu, boron digunakan sebagai berlumpur dalam paduan berbasis tembaga dan tembaga konduktansi tinggi. Dalam industri semikonduktor, sejumlah kecil boro ditambahkan sebagai agen doping silikon dan germanio.
Dapat melayani Anda: isopreno: struktur, sifat, aplikasiBoro oksida (b2SALAH SATU3) dicampur dengan silika untuk membuat kaca tahan panas (kaca borosilikat), digunakan dalam peralatan dapur dan peralatan laboratorium tertentu.
Boro carbide (b4C) Ini adalah zat yang sangat sulit yang digunakan sebagai agen abrasif dan penguatan dalam bahan komposit. Aluminium Boruro (Alb12) Ini digunakan sebagai pengganti debu berlian untuk buram dan dipoles.
Boro digunakan dalam paduan, misalnya dalam magnet tanah jarang, paduan dengan besi dan neodymium. Magnet yang terbentuk digunakan dalam pembuatan mikrofon, sakelar magnetik, headphone dan akselerator partikel.
Dalam kedokteran
Kapasitas isotop Boro-10 (10B) Untuk menangkap neutron, memancarkan radiasi tipe α telah digunakan untuk pengobatan tumor otak dalam teknik yang dikenal sebagai terapi penangkapan neutron boron (BNCT).
Dia 10B Dalam bentuk senyawa terakumulasi dalam tumor kanker. Selanjutnya, zona tumor dengan neutron terpancar. Ini berinteraksi dengan 10B, apa yang menyebabkan emisi partikel α. Partikel -partikel ini memiliki efek biologis relatif tinggi dan karena ukurannya yang besar mereka memiliki sedikit jangkauan.
Jadi aksi destruktif partikel α terbatas dalam sel tumor, melakukan penghancuran. BNCT juga digunakan dalam pengobatan tumor leher, hati, kandung kemih dan prostat.
Tindakan biologis
Sejumlah kecil asam borat atau boron berbentuk borerat diperlukan untuk pertumbuhan banyak tanaman. Kekurangan boron dimanifestasikan dalam pertumbuhan tanaman yang cacat; "Hati coklat" sayuran; dan "busuk kering" bit gula.
Boron mungkin diperlukan dalam jumlah kecil untuk menjaga kesehatan tulang. Ada penelitian yang menunjukkan bahwa kurangnya boron akan terlibat dalam pembangkitan radang sendi. Itu juga akan campur tangan dalam fungsi otak seperti memori dan koordinasi mata-manusia.
Beberapa ahli menunjukkan bahwa 1,5 hingga 3 mg boron harus dimasukkan dalam diet harian.
Risiko dan hati -hati
Boron, boron oksida, asam borat dan boratos, dianggap tidak -toksik. LD50 untuk hewan adalah 6 g boron/kg berat badan, sedangkan zat dengan LD50 lebih besar dari 2 g/kg berat badan dianggap tidak beroksic.
Di sisi lain, konsumsi lebih dari 0,5 mg/boron hari selama 50 hari menyebabkan masalah pencernaan kecil, menunjukkan toksisitas. Beberapa laporan menunjukkan bahwa kelebihan asupan boron dapat mempengaruhi fungsi lambung, hati, ginjal dan otak.
Demikian juga, efek iritasi jangka pendek telah ditunjukkan pada nasofaring, saluran pernapasan atas dan mata untuk paparan boron.
Laporan tentang toksisitas boron langka dan dalam banyak kasus, toksisitas disajikan pada dosis yang sangat tinggi, lebih tinggi dari populasi umum terpapar.
Rekomendasi ini adalah memantau kandungan boron makanan, terutama sayuran dan buah -buahan. Lembaga kesehatan pemerintah harus memantau bahwa konsentrasi boron air tidak melebihi batas yang diizinkan.
Pekerja yang terpapar debu yang mengandung boron harus memakai topeng yang melindungi saluran pernapasan, sarung tangan dan sepatu bot khusus.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Alotrop Boron. Diperoleh dari: di.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Kuliah 5b. Struktur elemen (non-logam, b, c). Departemen Kimia, Universitas Hindia Barat, Kampus Mona, Kingston 7, Jamaika. Pulih dari: chem.Uwimona.Edu.Jm
- Manisha Lalloo. (28 Januari 2009). Struktur boron ultra-murni ditemukan. Dunia Kimia. Dipulihkan dari: ChemistryWorld.com
- Bell Terence. (16 Desember 2018). Profil boron logam. Pulih dari: keseimbangan.com
- Para editor Eeritlopaedia Britannica. (2019). Boron. Dipulihkan dari: Britannica.com
- Agen untuk zat beracun dan pendaftaran penyakit. (2010). Toxfaqs ™ di Boron. [PDF]. Diperoleh dari: ATSDR.CDC.Pemerintah
- Helmestine, Anne Marie, PH.D. (6 Februari 2019). Kimia Boron & Sifat Fisik. Pulih dari: thinkco.com

