Struktur aluminium karbonat, sifat, penggunaan
- 4792
- 473
- Tommie Smith
Dia Aluminium karbonat Itu adalah garam anorganik yang formula kimianya adalah2(BERSAMA3)3. Ini adalah karbonat logam yang praktis tidak ada, mengingat ketidakstabilan yang tinggi dalam kondisi normal.
Di antara alasan ketidakstabilannya, kita dapat menyebutkan interaksi elektrostatik yang lemah antara ion ke3+ dan co32-, yang secara teori harus sangat kuat untuk besaran bebannya.
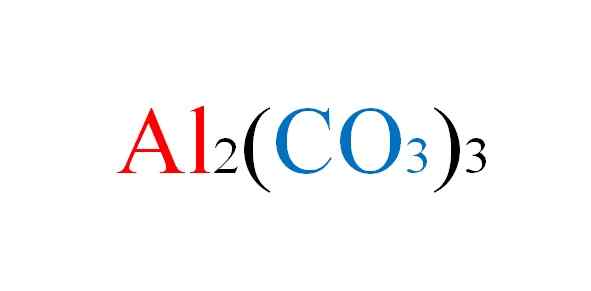 Formula aluminium karbonat. Sumber: Gabriel Bolívar.
Formula aluminium karbonat. Sumber: Gabriel Bolívar. Garam menghadapi ketidaknyamanan dalam kertas ketika persamaan kimia reaksinya ditulis; Tapi dalam praktiknya bertentangan dengan itu.
Terlepas dari apa yang dikatakan, aluminium karbonat dapat terjadi di perusahaan ion lain, seperti halnya dengan mineral Dawsonite. Ada juga turunan di mana ia berinteraksi dengan amonia berair. Sisanya, itu dianggap campuran antara al (OH)3 dan H2BERSAMA3; yang sama dengan larutan effervescent dengan endapan putih.
Campuran ini memiliki penggunaan obat. Namun, untuk garam Al yang murni, terisolasi dan dapat dimanipulasi2(BERSAMA3)3, Anda tidak diketahui aplikasi yang mungkin; Setidaknya tidak tekanan besar atau kondisi ekstrem.
[TOC]
Struktur aluminium karbonat
Struktur kristal untuk garam ini tidak diketahui, karena sangat tidak stabil sehingga belum dapat dikarakterisasi. Dari formulanya ke2(BERSAMA3)3, Namun, diketahui bahwa proporsi ion ke3+ dan co32- Ini adalah 2: 3; artinya setiap dua kation ke2+ Pasti ada tiga anion co32- berinteraksi secara elektrostatik dengan mereka.
Masalahnya adalah bahwa kedua ion sangat tidak setara mengenai ukurannya; al3+ Itu sangat kecil saat co32- Itu besar. Perbedaan ini dengan sendirinya sudah mempengaruhi stabilitas reticular dari jaringan kristal, yang ionnya akan berinteraksi "canggung" jika garam dalam keadaan padat ini terisolasi.
Itu dapat melayani Anda: Nomor Avogadro: Sejarah, Unit, Bagaimana Dihitung, PenggunaanSelain aspek ini, AL3+ Ini adalah kation yang sangat terpolarisasi, properti yang merusak awan elektronik CO32-. Seolah -olah dia ingin memaksanya untuk menghubungkan secara kovalen, meskipun anion tidak dapat melakukannya.
Akibatnya, interaksi ionik antara Al3+ dan co32- Mereka cenderung ke arah kovalensi; Faktor lain yang menambah ketidakstabilan AL2(BERSAMA3)3.
Hydroxide Carbonate Aluminium Ammonium
Hubungan kacau antara al3+ dan co32- Ini melembutkan dalam penampilan ketika ada ion lain yang ada di kaca; seperti NH4+ dan oh-, dari solusi amonia. Kuartet ion ini, ke3+, BERSAMA32-, NH4+ dan oh-, Mereka berhasil mendefinisikan kristal yang stabil, bahkan mampu mengadopsi morfologi yang berbeda.
Contoh lain yang serupa dengan ini diamati dalam mineral Dawsonite dan kristal ortorombiknya, Naalco3(OH)2, Dimana na+ Ganti NH4+. Dalam garam ini, ikatan ionik mereka cukup kuat sehingga air tidak mempromosikan pelepasan CO2; atau setidaknya tidak tiba -tiba.
Meskipun NH4Al (oh)2BERSAMA3 (AACC, untuk Sigles -nya dalam bahasa Inggris), maupun Naalco3(OH)2 Mereka mewakili aluminium karbonat, mereka dapat dianggap sebagai turunan dasar yang sama.
Properti
Masa molar
233.98 g/mol.
Ketidakstabilan
Pada bagian sebelumnya dijelaskan dari perspektif molekuler mengapa al2(BERSAMA3)3 Itu tidak stabil. Tapi transformasi apa yang diderita? Anda harus mempertimbangkan dua situasi: satu kering, dan yang lainnya "basah".
Kering
Dalam situasi kering, co anion32- CO dibalik2 Melalui dekomposisi berikut:
Ke2(BERSAMA3)3 => Al2SALAH SATU3 + 3co2
Ini dapat melayani Anda: kalsium fosfat (CA3 (PO4) 2)Yang masuk akal jika disintesis di bawah alumina untuk tekanan besar CO2; yaitu reaksi terbalik:
Ke2SALAH SATU3 + 3co2 => Al2(BERSAMA3)3
Oleh karena itu, untuk menghindari membusuk AL2(BERSAMA3)3 Anda harus mengirimkan garam ke tekanan besar (menggunakan n2, Misalnya). Dengan cara ini pembentukan CO2 tidak akan disukai secara termodinamik.
Basah
Sementara dalam situasi basah, CO32- Itu menderita hidrolisis, yang menghasilkan sedikit oh-; Tapi cukup untuk aluminium hidroksida untuk mengendap, di (OH)3:
BERSAMA32- + H2Atau hco3- + Oh-
Ke3+ + 3OH- Al (oh)3
Dan di sisi lain, AL3+ Itu juga dihidrolisis:
Ke3+ + H2Atau ke (oh)22+ + H+
Meskipun akan benar -benar terhidrasi3+ Untuk membentuk kompleks ke (h2SALAH SATU)63+, yang dihidrolisis untuk diberikan [ke (h2SALAH SATU)5Oh]2+ dan H3SALAH SATU+. Lalu, h3Atau (atau h+) Protona untuk CO32- untuk h2BERSAMA3, yang rusak menjadi co2 dan H2SALAH SATU:
BERSAMA32- + 2h+ => H2BERSAMA3
H2BERSAMA3 BERSAMA2 + H2SALAH SATU
Perhatikan bahwa pada akhirnya AL3+ Itu berperilaku seperti asam (lepaskan h+) dan pangkalan (rilis oh- Dengan keseimbangan kelarutan AL (OH)3); yaitu, menunjukkan amfoterisme.
Fisik
Untuk dapat mengisolasi dirinya sendiri, garam ini cenderung putih, seperti banyak garam aluminium lainnya. Juga, karena perbedaan antara radio ionik dari Al3+ dan co32-, Tentunya akan memiliki titik leleh atau mendidih yang sangat rendah dibandingkan dengan senyawa ionik lainnya.
Ini dapat melayani Anda: Benchilo: Benzyl Hydogen, Karbokations, Benzyl RadicalsDan mengenai kelarutannya, itu akan larut dalam air. Selain itu, itu akan menjadi solid higroskopis dan lezat. Namun, ini hanya dugaan. Properti lain harus diperkirakan dengan model perhitungan yang tunduk pada tekanan tinggi.
Aplikasi
Aplikasi yang diketahui dari aluminium karbonat adalah medis. Itu digunakan sebagai astringen lunak dan sebagai obat untuk mengobati peradangan dan ulkus lambung. Ini juga telah digunakan untuk mencegah pembentukan perhitungan urin pada manusia.
Ini telah digunakan untuk mengontrol peningkatan kandungan tubuh fosfat dan juga untuk mengobati gejala keasaman lambung, gangguan pencernaan dan ulkus lambung.
Referensi
- Xuehui l., Zhe t., Yongming c., Ruiyu Z. & Chenguang L. (2012). Sintesis hidrotermal nanoplatelet amonium aluminium karbonat hidroksida (Aach) dan morfologi yang dikendalikan pH nanofiber. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boulleg, Didier Colson, Francois Puel (2017) Ammonium aluminium karbonat hidroksida NH4AL (OH) 2CO3 sebagai rute alternatif untuk persiapan aluminium: perbandingan boehmite klasik. Teknologi bubuk, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Pusat Nasional Informasi Bioteknologi. (2019). Aluminium karbonat. Database pubchem., CID = 1035396. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Wikipedia. (2019). Aluminium karbonat. Diperoleh dari: di.Wikipedia.org
- Aluminiumsulfate. (2019). Aluminium karbonat. Pulih dari: aluminiumsulfate.bersih

