Amonium karbonat ((NH4) 2CO3)
- 4964
- 335
- Ernesto Mueller
Apa itu amonium karbonat?
Dia Amonium karbonat Ini adalah garam nitrogen anorganik, khususnya amoniak, yang formulanya kimianya (NH4)2BERSAMA3. Ini dielaborasi dengan metode sintesis, di antaranya layak menggunakan sublimasi campuran amonium sulfat dan kalsium karbonat: (NH4)2Sw4(S)+ Caco3(s) => (nh4)2BERSAMA3case+ case4(S).
Secara umum, garam amonium dan kalsium karbonat dipanaskan dalam wadah untuk menyebabkan amonium karbonat. Metode industri yang menghasilkan berton -ton garam ini adalah dengan melewati karbon dioksida melalui kolom penyerapan yang berisi larutan amonium dalam air, kemudian melakukan distilasi.
Uap yang mengandung amonium, karbon dioksida dan air dikondensasi untuk membentuk kristal amonium karbonat: 2nh3(g)+ h2Atau (l) + co2(g) → (NH4)2BERSAMA3(S). Dalam reaksi asam karbonat terjadi, h2BERSAMA3, Setelah melarutkan karbon dioksida di dalam air, dan asam inilah yang menghasilkan dua protonnya, h+, untuk dua molekul amonia.
Sifat amonium karbonat
 Penampilan amonium karbonat
Penampilan amonium karbonat Ini adalah warna putih, kristal dan tidak berwarna, dengan aroma yang kuat dan rasa amonia. Meleleh sampai 58 °.
Namun, dekomposisi ini terjadi dalam dua langkah: pertama molekul NH dilepaskan3, memproduksi amonium bikarbonat (NH4HCO3); Dan kedua, jika pemanasan berlanjut, karbonat adalah ketidakproporsional.
Ini adalah larut dalam air dan kurang larut dalam alkohol. Bentuk jembatan hidrogen dengan air, dan ketika 5 gram larut dalam 100 gram air, ia menghasilkan solusi dasar dengan pH sekitar 8,6.
Dapat melayani Anda: pengemulsi: proses emulsi, aspek molekuler, aplikasiAfinitas tinggi terhadap air dibuat oleh padatan higroskopis (menyerap kelembaban), dan itulah sebabnya sulit untuk menemukannya dalam bentuk anhidridnya. Faktanya, bentuk monohidratnya, (NH4)2BERSAMA3· H2O), adalah yang paling umum dari semuanya dan menjelaskan bagaimana garam adalah pembawa gas amonia, menyebabkan bau.
Di udara rusak untuk menghasilkan amonium bikarbonat dan amonium karbonat (NH4NH2BERSAMA2).
Struktur kimia
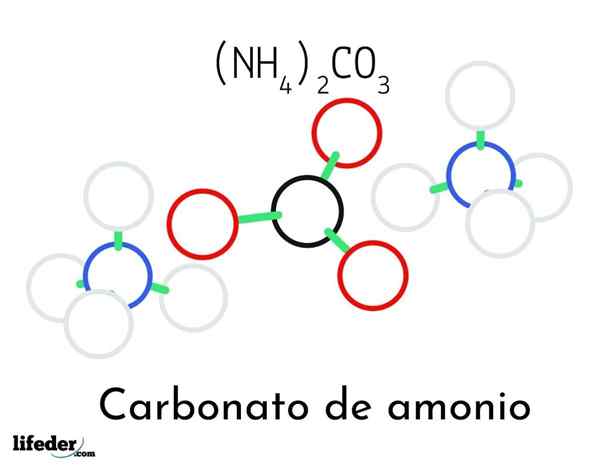
 Model struktur amonium karbonat; Dua amonium dan satu kation karbonat
Model struktur amonium karbonat; Dua amonium dan satu kation karbonat Dalam gambar superior struktur kimia amonium karbonat diilustrasikan. Di tengah adalah co anion32-, segitiga datar dengan pusat hitam dan bola merah; Dan ke dua sisinya, kation amonios nh4+ dengan geometri tetrahedral.
Geometri ion amonium dijelaskan oleh hibridisasi SP3 dari atom nitrogen, memesan atom hidrogen (bola putih) di sekitarnya dalam bentuk tetrahedron. Di antara tiga ion ditetapkan oleh jembatan hidrogen (h3N-h- o-co22-).
Berkat geometri, satu co -anion32- dapat membentuk hingga tiga jembatan hidrogen; sedangkan NH Cation4+ Mungkin mereka tidak dapat membentuk empat jembatan hidrogen yang sesuai karena penolakan elektrostatik di antara muatan positif mereka.
Hasil dari semua interaksi ini adalah kristalisasi sistem ortorombik. Mengapa begitu higroskopis dan larut dalam air? Jawabannya adalah dalam paragraf sebelumnya yang sama: jembatan hidrogen.
Interaksi ini bertanggung jawab atas penyerapan air yang cepat dari garam anhidrida (NH4)2BERSAMA3· H2SALAH SATU). Ini menghasilkan perubahan dalam pengaturan spasial ion, dan oleh karena itu, dalam struktur kristal.
Itu dapat melayani Anda: nikel klorida (NICL2): struktur, sifat, mendapatkan, menggunakanKeingintahuan struktural
Tidak peduli seberapa sederhana (NH terlihat seperti itu4)2BERSAMA3, Sangat sensitif terhadap transformasi yang tak terhitung jumlahnya sehingga strukturnya adalah misteri yang diserahkan ke komposisi sebenarnya dari padatan. Struktur ini juga bervariasi sesuai dengan tekanan yang mempengaruhi kristal.
Beberapa penulis telah menemukan bahwa ion dipesan sebagai coplanares yang dilapisi oleh jembatan hidrogen (yaitu, rantai dengan urutan NH4+-BERSAMA32--...) di mana molekul air mungkin berfungsi sebagai konektor ke rantai lain.
Terlebih lagi, melampaui langit terestrial, bagaimana kristal ini dalam kondisi spasial atau antarbintang? Apa komposisi Anda dalam hal stabilitas spesies berkarbonasi? Ada penelitian yang mengkonfirmasi stabilitas hebat dari kristal -kristal ini yang terperangkap dalam massa es planet dan komet.
Ini memungkinkan mereka untuk berfungsi sebagai cadangan karbon, nitrogen dan hidrogen, yang, menerima radiasi matahari, dapat diubah menjadi bahan organik seperti asam amino.
Artinya, blok amoniak es krim ini bisa menjadi pembawa "roda yang memulai mesin kehidupan" di kosmos. Karena alasan ini, minat mereka pada bidang astrobiologi dan biokimia meningkat.
Penggunaan/Aplikasi
Ini digunakan sebagai leuers, karena dipanaskan menghasilkan karbon dioksida dan gas amonium. Ammonium karbonat, jika Anda mau, merupakan pendahulu dari baking powder modern dan dapat digunakan untuk memanggang kue dan biskuit datar.
Namun, penggunaannya untuk memanggang kue tidak disarankan. Karena ketebalan kue, gas amonium dipertahankan di dalam dan menghasilkan rasa yang tidak menyenangkan.
Itu dapat melayani Anda: cyclohexen: struktur, sifat, sintesis dan penggunaanItu digunakan sebagai ekspekoran, yaitu, meringankan batuk saat mendekongest bronchi. Ini memiliki aksi fungisida, menggunakan karena alasan ini di bidang pertanian. Ini juga merupakan pengatur keasaman yang ada dalam makanan dan digunakan dalam sintesis urea organik dalam tekanan tinggi, dan hidantoinas.
Risiko
Amonium karbonat sangat beracun. Itu menghasilkan pada manusia iritasi akut pada rongga mulut saat menghubungkan.
Selain itu, jika dicerna menyebabkan iritasi lambung. Tindakan serupa diamati pada mata yang terpapar amonium karbonat.
Menghirup gas dekomposisi garam, dapat mengiritasi hidung, tenggorokan dan paru -paru, menyebabkan batuk dan gangguan pernapasan.
Paparan anjing akut pada ammonat ammonat pada dosis berat 40 mg/kg, menyebabkan muntah dan diare. Dosis tertinggi amonium karbonat (200 mg/kg berat badan) biasanya mematikan. Kerusakan jantung ditunjukkan sebagai penyebab kematian.
Jika dipanaskan pada suhu yang sangat tinggi dan di udara yang diperkaya dengan oksigen, ia mengeluarkan gas beracun2.
Referensi
- Pubchem. (2018). Amonium karbonat. Diperoleh pada 25 Maret 2018, dari Pubchem: Pubchem.NCBI.Nlm.Nih.Pemerintah
- Portal Kimia Organik. ((2009-2018)). Reaksi Bucherer-Bergs. Diperoleh pada 25 Maret 2018, dari Portal Kimia Organik: www.Kimia organik.org
- Wikipedia. (2018). Amonium karbonat. Diperoleh pada 25 Maret 2018, dari Wikipedia: di.Wikipedia.org
- Perusahaan Kimia. (2018). Perusahaan Kimia. Diperoleh pada 25 Maret 2018, dari The Chemical Company: Thechemco.com