Karakteristik, struktur, fungsi, patologi
- 1158
- 217
- Miss Marion Graham
Itu katalase Ini adalah enzim oksidoreduktase (H2O2: H2O2 oksidorreduktase) yang tersebar luas di alam. Katalisasi, dalam berbagai jaringan dan jenis sel, reaksi “dekomposisi” hidrogen peroksida dalam oksigen molekuler dan air.
Pengamatan pertama dari jenis enzim ini berasal dari awal 1810 -an, tetapi pada tahun 1901 ketika Loew mengakui bahwa katalase hampir hadir di semua organisme hidup yang ada dan dalam berbagai jenis sel yang berbeda.
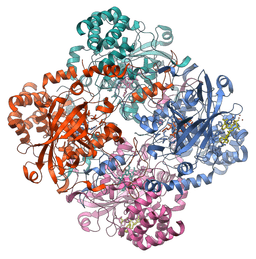
 Struktur molekul enzim katalase (Sumber: Vossman [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] via Wikimedia Commons)
Struktur molekul enzim katalase (Sumber: Vossman [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] via Wikimedia Commons) Enzim ini, penting untuk pemeliharaan integritas seluler dan regulator utama metabolisme hidrogen peroksida, adalah faktor mendasar untuk menegaskan bahwa di alam ada enzim yang bertindak pada substrat spesifik.
Mamalia dan organisme lain memiliki enzim katalas yang juga dapat berperilaku seperti peroksidase, mengkatalisasi reaksi pengoksidasi dari substrat yang berbeda menggunakan hidrogen peroksida.
Di sebagian besar eukariota, enzim katalas lebih banyak lagi pada organel subseluler yang dikenal sebagai "peroksisom", dan pada manusia ada banyak kondisi patologis yang terkait dengan kekurangan enzim ini.
[TOC]
Karakteristik
Aktivitas enzim seperti katalase dapat sangat bervariasi tergantung pada jenis jaringan yang dipertimbangkan. Pada mamalia, misalnya, aktivitas katalase adalah signifikan baik di ginjal dan di hati, dan jauh lebih rendah di jaringan ikat.
Sehingga katalase pada mamalia terutama terkait dengan semua jaringan yang memiliki metabolisme aerobik yang signifikan.
Mamalia memiliki katalas baik di mitokondria dan peroksisom dan di kedua kompartemen adalah enzim yang terkait dengan membran organelary. Dalam eritrosit, sebaliknya, aktivitas katalase dikaitkan dengan enzim yang larut (ingat bahwa eritrosit memiliki organel internal yang langka).
Dapat melayani Anda: Half Stuart: Foundation, Persiapan dan PenggunaanCatalase adalah enzim dengan jumlah penggantian atau katalitik konstan yang tinggi (sangat cepat dan efisien) dan reaksi umum yang mengkatalisasi adalah sebagai berikut:
2H2O2 → 2H2O + O2
In the presence of low concentrations of hydrogen peroxide, mammal catalase, for example, behaves like an oxidase, using molecular oxygen (O2) to oxidize molecules such as indole and β-penylethylamine, precursors of the tryptophan amino acid and a neurotransmitter, respectively.
Beberapa inhibitor kompetitif aktivitas katalase saat ini diketahui dan di antaranya menonjol natrium dan 3-amynotriazole azid. Azida, dalam bentuk anioniknya, adalah penghambat kuat protein lain dengan kelompok hemo dan digunakan untuk eliminasi atau pencegahan pertumbuhan mikroorganisme dalam kondisi yang berbeda.
Struktur
Pada manusia, katalase diberi kode oleh gen 34 kb yang memiliki 12 intron dan 13 ekson dan mengkodekan untuk protein asam amino 526.
Mayoritas katalas yang diteliti adalah enzim tetramerik dengan berat molekul mendekati 240 kDa (60 kDa untuk setiap subunit) dan setiap monomer dikaitkan dengan kelompok prostetik hemine atau ferroprotoporfirinininin.
Strukturnya terdiri dari empat domain yang terdiri dari struktur sekunder yang dibentuk oleh neraka alfa dan lembaran β-moys, dan penelitian yang dilakukan dalam enzim hati manusia dan sapi telah menunjukkan bahwa protein ini terkait dengan empat molekul NADPH NADPH.
Molekul NADPH ini tampaknya tidak penting untuk aktivitas enzimatik katalase (untuk produksi air dan oksigen dari hidrogen peroksida), tetapi tampaknya berhubungan dengan penurunan kerentanan enzim ini dibandingkan dengan konsentrasi tinggi dari substrat beracunnya yang tinggi.
Domain masing -masing subunit dalam katalase manusia adalah:
Dapat melayani Anda: karotenoid-Lengan N-terminal non-globular yang diperluas, yang berfungsi untuk stabilisasi struktur kuaterner
-Β-barrel dari delapan β lipat antiparalel, yang menyediakan beberapa residu persimpangan lateral ke kelompok hemo
-Domain "pembungkus" yang mengelilingi domain luar, termasuk kelompok hemo dan, akhirnya
-Domain dengan struktur baling -baling alpha
Keempat subunit, dengan empat domain ini, bertanggung jawab untuk pembentukan saluran panjang yang ukurannya sangat penting untuk mekanisme pengakuan hidrogen peroksida oleh enzim (yang menggunakan asam amino seperti histidin, asparagin, glutamin dan asam aspartat untuk itu ).
Fungsi
Menurut beberapa penulis, Catalase memenuhi dua fungsi enzimatik:
-Dekomposisi hidrogen peroksida dalam air molekul dan oksigen (sebagai peroksidase spesifik).
-Oksidasi donor proton, seperti metanol, etanol, banyak fenol format dan asam, menggunakan mol hidrogen peroksida (seperti peroksidase nonspesifik).
-Dalam eritrosit, sejumlah besar katalase tampaknya memainkan peran penting dalam perlindungan hemoglobin di depan agen pengoksidasi, seperti hidrogen peroksida, asam askorbat, methylhydrazine dan lainnya.
Enzim yang ada dalam sel -sel ini bertanggung jawab atas pertahanan jaringan lain dengan sedikit aktivitas katalase dibandingkan dengan konsentrasi tinggi hidrogen peroksida.
-Beberapa serangga seperti kumbang bomber menggunakan katalase sebagai mekanisme pertahanan, karena hidrogen peroksida terurai dan menggunakan produk oksigen gas dari reaksi tersebut untuk mendorong output air dan senyawa kimia lainnya dalam bentuk.
-Pada tanaman, katalase (juga ada dalam peroksisom) adalah salah satu komponen mekanisme photorerspirasi, di mana fosfoglisat yang diproduksi oleh enzim Rubisco digunakan untuk produksi 3-fosfogliserasi.
Dapat melayani Anda: siklus loosPatologi terkait pada manusia
Sumber utama produksi substrat katalase, hidrogen peroksida, adalah reaksi yang dikatalisis oleh enzim oksidase, spesies oksigen reaktif dan beberapa sel tumor.
Senyawa ini terlibat dalam proses inflamasi, dalam ekspresi molekul perekat, dalam apoptosis, dalam regulasi agregasi trombosit dan dalam kontrol proliferasi sel.
Ketika ada kekurangan enzim ini, konsentrasi substratnya yang tinggi dihasilkan, yang menghasilkan lesi pada membran sel, cacat transportasi elektronik pada mitokondria, dalam metabolisme homosistein dan dalam DNA.
Di antara penyakit yang terkait dengan mutasi pada gen pengkodean untuk katalase manusia dapat disebutkan:
-Diabetes mellitus
-Hipertensi arteri
-Alzheimer
-Vitiligo dan lainnya
Referensi
- Agar, n., Sadrzadeh, s., Findo, hlm., & Eaton, J. (1986). Eritrosit katalase. Pertahanan oksidan somatik? J. Clin. Menginvestasikan., 77, 319-321.
- Góth, l., Rass, hlm., & Membayar. (2004). Mutasi enzim katalase dan hubungannya dengan desain. Diagnosis molekuler, 8(3), 141-149.
- Kirkman, h., & Gaetanit, G. F. (1984). Katalase: enzim tetramerik dengan empat molekul NADPH yang terikat erat. Proc. Natl. Acade. Sci. Penggunaan, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, G. F. (2006). Mammalian Catalase: Enzim Yang Mulia dengan Misteri Baru. Tren ilmu biokimia, 32(1), 44-50.
- Rawn, J. D. (1998). Biokimia. Burlington, Massachusetts: Penerbit Neil Patterson.
- Salomo, e., Berg, l., & Martin, D. (1999). Biologi (Edisi ke -5.). Philadelphia, Pennsylvania: Saunders College Publishing.
- Vinshtein, b., Melik-Adamyan, w., Barynin, v., Vagin, a., & Grebenko, a. (1981). Struktur tiga dimensi enzim katalase. Alam, 293(1), 411-412.
- « Karakteristik, struktur, fungsi lacasas
- Karakteristik Gerakan Burkasial yang Dipercepat Secara Seragam, Formula »

