Bagian sel galvanik, cara kerja, aplikasi, contoh

- 2843
- 874
- Domingo Gutkowski
Itu Sel galvanik o Sel volta adalah jenis sel elektrokimia yang terdiri dari dua logam berbeda yang direndam dalam dua semi -lad, di mana senyawa dalam larutan aktif adalah reaksi spontan.
Kemudian, salah satu logam di salah satu semi -lad dioksidasi sedangkan logam semi -media lainnya berkurang, menghasilkan pertukaran elektron melalui sirkuit eksternal. Ini memungkinkan untuk memanfaatkan arus listrik.
 Gambar 1. Skema dan bagian dari sel galvanik. Sumber: Korintus.PUCP.Edu.pe.
Gambar 1. Skema dan bagian dari sel galvanik. Sumber: Korintus.PUCP.Edu.pe. Nama "sel galvanik" adalah untuk menghormati salah satu pelopor eksperimen dengan listrik: dokter dan ahli fisiologi Italia Luigi Galvani (1737-1798).
Galvani ditemukan pada 1780 bahwa jika mereka bergabung dengan satu ujung kabel dari logam yang berbeda dan ujung bebas diletakkan berhubungan dengan ANCA katak (mati), maka kontraksi terjadi.
Namun, yang pertama membangun sel elektrokimia untuk menghasilkan listrik juga adalah Italia Alessandro Volta (1745-1827) pada tahun 1800 dan karenanya nama alternatif sel voltaik.
Bagian sel galvanik
Bagian sel galvanik ditunjukkan pada Gambar 1 dan sebagai berikut:
1.- Semi -Media Anodik
2.- Elektroda anodium
3.- Solusi anodik
4.- Semi -Media Katodik
5.- Elektroda katodik
6.- Solusi katodik
7.- Jembatan Saline
8.- Konduktor logam
9.- Voltmeter
Berfungsi
Untuk menjelaskan fungsi sel galvanik, kami akan mengandalkan yang lebih rendah:
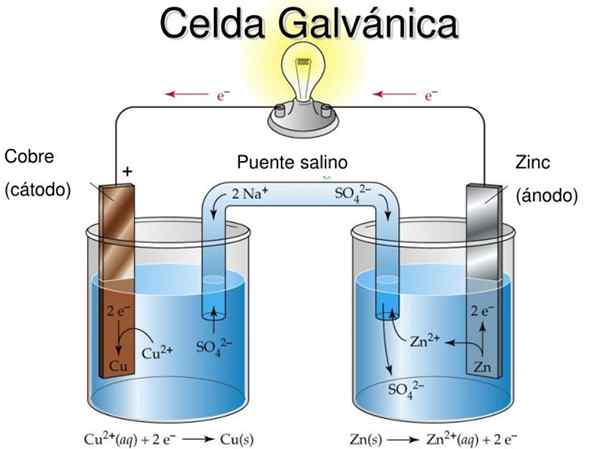 Gambar 2. Model didaktik sel galvanik. Sumber: SlideServe.com
Gambar 2. Model didaktik sel galvanik. Sumber: SlideServe.com Gagasan mendasar dari sel galvanik adalah bahwa logam yang diderita oleh reaksi oksidasi secara fisik dipisahkan dari logam yang berkurang, sehingga pertukaran elektron terjadi melalui konduktor eksternal yang memungkinkan untuk mengambil keuntungan dari aliran arus listrik listrik , Misalnya menyalakan bohlam atau LED.
Pada Gambar 2 di semi -media di sebelah kiri Anda memiliki pita tembaga logam (Cu) yang direndam dalam larutan tembaga sulfat (CUS04), Saat berada di semi -lid yang tepat ada selotip (Zn) yang direndam dalam larutan seng sulfat (Znso4).
Perlu dicatat bahwa di setiap semi -media masing -masing logam hadir dalam dua keadaan oksidasi: atom logam netral dan ion logam dari garam dari logam yang sama dalam larutan.
Jika kaset logam tidak dihubungkan dengan kabel konduktif eksterior, maka kedua logam teroksidasi secara terpisah dalam selnya masing -masing.
Namun, ketika terhubung secara elektrik, oksidasi akan terjadi pada Zn sementara akan ada reaksi reduksi di Cu. Ini karena tingkat oksidasi seng lebih besar dari tembaga.
Logam yang mengoksidasi menghasilkan logam yang dikurangi melalui konduktor luar dan aliran arus ini dapat digunakan.
Dapat melayani Anda: turunan terhalogenasiReaksi oksidasi dan reduksi
Reaksi yang terjadi di sisi kanan antara elektroda logam seng dan larutan seng sulfat berair adalah sebagai berikut:
Znsalah satu(S) + Zn2+ (SW4)2- → 2 Zn2+(AC) + (SW4)2- + 2 e-
Atom seng (padatan) pada permukaan elektroda anodik di semi -ti -kanan, distimulasi oleh ion positif dari seng dalam larutan, menghasilkan dua elektron dan muncul dari elektroda, masuk ke larutan berair yang berair pada larutan berairous sebagai ion ganda positif seng.
Kami menyadari bahwa hasil bersihnya adalah atom seng logam netral, dengan kehilangan dua elektron, menjadi ion seng yang menambah larutan berair, sehingga batang seng kehilangan atom dan solusi memperoleh ion ganda positif yang positif.
Elektron yang dibebaskan akan lebih suka bergerak melalui kabel eksternal menuju logam semi -media lainnya dengan beban positif (cartodo +). Bilah seng kehilangan massa karena atom -atomnya secara bertahap beralih ke larutan berair.
Oksidasi seng dapat diringkas sebagai berikut:
Znsalah satu(S) → Zn2+(AC) + 2 e-
Reaksi yang terjadi di sisi kiri serupa, tetapi tembaga larutan berair menangkap dua elektron (berasal dari yang semi -bertema) dan disimpan dalam elektroda tembaga. Ketika atom menangkap elektron, dikatakan dikurangi.
Reaksi reduksi tembaga ditulis seperti ini:
Cu2+(AC) + 2 e- → Cusalah satu(S)
Bilah tembaga mendapatkan adonan, karena ion solusi lewat ke bar.
Oksidasi terjadi pada anoda (negatif), yang mengusir elektron, sedangkan reduksi terjadi pada katoda (positif), yang menarik elektron. Pertukaran elektron terjadi melalui driver eksternal.
Jembatan Saline
Jembatan Saline menyeimbangkan beban yang menumpuk di dua semi -lies. Dalam anodik semi -diad, ion positif terakumulasi, sedangkan dalam katodik ada kelebihan ion sulfat negatif.
Untuk jembatan saline, larutan garam (seperti natrium klorida atau kalium klorida) yang digunakan yang tidak campur tangan dalam reaksi, yang ada dalam tabung berbentuk U terbalik dengan ujungnya dicolokkan dengan dinding bahan berpori.
Satu -satunya tujuan jembatan saline adalah agar ion disaring untuk setiap penyeimbangan sel atau menetralkan beban berlebih. Dengan demikian, melalui jembatan saline ada aliran arus, melalui ion saline, yang menutup sirkuit listrik.
Potensi oksidasi dan reduksi
Potensi oksidasi dan reduksi standar dipahami.
Itu dapat melayani Anda: skandio: sejarah, sifat, reaksi, risiko dan penggunaanUntuk seng potensi oksidasi standarnyasapi = +0.76 v. Sementara itu, potensi pengurangan standar untuk tembaga adalah dankisi = +0.34 v. Gaya elektromotif (FEM) yang diproduksi oleh sel galvanik ini adalah: FEM = +0,76 V + 0,34 V = 1,1 V.
Reaksi global sel galvanik dapat ditulis seperti ini:
Znsalah satu(S) + Cu2+(AC) → Zn2+(AC) + Cusalah satu(S)
Mempertimbangkan sulfat, reaksi bersih adalah:
Znsalah satu(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ Cusalah satu(S)
Sulfat adalah penonton, sementara logam bertukar elektron.
Representasi simbolik sel galvanik
Sel galvanik Gambar 2 secara simbolis direpresentasikan sebagai berikut:
Znsalah satu(S)| Zn2+(AC) (1m) || Cu2+(AC) (1m) | Cusalah satu(S)
Dengan konvensi, di sebelah kiri logam yang mengoksidasi dan membentuk anoda (-) dan dipisahkan oleh batang (|) ionnya dalam keadaan berair selalu ditempatkan. Semi -medium anodik dipisahkan dari katodik oleh dua batang (||) yang mewakili jembatan saline. Di sebelah kanan, semi -medium logam yang dikurangi dan membentuk katoda (+) ditempatkan.
Dalam representasi simbolis sel galvanik ujungnya selalu logam yang mengoksidasi dan pada akhirnya logam ditempatkan (dalam keadaan padat) yang dikurangi. Perlu dicatat bahwa pada Gambar 2 semikel secara terbalik sehubungan dengan representasi simbolik konvensional.
Aplikasi
Diketahui potensi oksidasi standar dari berbagai logam yang berbeda dimungkinkan untuk menentukan gaya elektromotif yang akan menghasilkan tumpukan galvanik yang dibangun dengan logam ini.
Pada bagian ini, yang di atas akan berlaku di bagian sebelumnya untuk menghitung gaya elektromotor bersih sel yang dibangun dengan logam lain.
Sebagai contoh aplikasi kami mempertimbangkan sel besi galvanik (iman) dan tembaga (CU). Sebagai data, reaksi reduksi berikut dan potensi reduksi standarnya diberikan, yaitu, pada konsentrasi 25ºC dan 1M:
Keyakinan2+(AC) + 2 e- → Iman(S). E1kisi = -0.44 v
Cu2+(AC) + 2 e- → Cu(S). E2kisi = +0.34 v
Itu diminta untuk menemukan gaya elektromotor bersih yang diproduksi oleh sel galvanik berikut:
Keyakinan(S)| Faith2+(AC)(1m) || cu2+(AC)| Cu(S)
Di tumpukan ini besi beroksidasi dan merupakan anoda sel galvanik, sedangkan tembaga sedang dikurangi dan merupakan katoda. Potensi oksidasi besi adalah sama tetapi berlawanan dengan potensi reduksinya, yaitu E1Oxd = +0.44.
Untuk mendapatkan gaya elektromotif yang dihasilkan oleh sel galvanik ini, kami menambahkan potensi oksidasi besi dengan potensi reduksi tembaga:
Dapat melayani Anda: nitrogen oksida (NOX)fem = e1Oxd + E2kisi = -E1kisi + E2kisi = 0,44 V + 0,34 V = 0,78 V.
Sel galvanik dalam kehidupan sehari -hari
Sel galvanik untuk penggunaan sehari -hari jauh dari bentuk yang digunakan sebagai model didaktik, tetapi prinsip operasinya sama.
Sel penggunaan yang paling umum adalah baterai alkali 1.5V dalam presentasi yang berbeda. Nama depan datang karena itu adalah satu set sel yang terhubung secara seri untuk meningkatkan FEM.
Baterai lithium yang dapat diisi ulang juga didasarkan pada prinsip pengoperasian sel galvanik yang sama dan yang digunakan dalam smartphone, jam tangan dan perangkat lainnya.
Dengan cara yang sama baterai timah mobil, sepeda motor dan kapal adalah 12V dan didasarkan pada prinsip pengoperasian sel galvanik yang sama.
Sel galvanik digunakan dalam estetika dan regenerasi otot. Ada perawatan wajah yang terdiri dari penerapan arus dengan dua elektroda dalam bentuk roller atau bola yang membersihkan dan mengencangkan kulit.
Pulsa saat ini juga berlaku untuk meregenerasi otot -otot pada orang yang berada dalam keadaan sujud.
Konstruksi sel galvanik buatan sendiri
Ada banyak cara untuk membangun sel galvanik buatan sendiri. Salah satu yang paling sederhana adalah menggunakan cuka sebagai larutan, kuku baja dan kabel tembaga.
Bahan
-Kapal plastik sekali pakai
-cuka putih
-Dua sekrup baja
-Dua potong kawat tembaga telanjang (tanpa isolasi atau pernis)
-Voltmeter
Prosedur
-Isi ¾ bagian gelas dengan cuka.
-Bergabunglah dengan dua sekrup baja dengan beberapa putaran kawat, tinggalkan sepotong kawat tanpa belitan.
Ujung tak berujung kabel tembaga dilipat dalam berbentuk U terbalik.
 Gambar 3. Sel galvanik buatan sendiri dan multimeter. Sumber: YouTube.com
Gambar 3. Sel galvanik buatan sendiri dan multimeter. Sumber: YouTube.com Sepotong kabel tembaga lain juga dilipat menjadi terbalik dan menggantung di tepi kaca dalam posisi berlawanan secara diametris ke sekrup yang terendam, sehingga satu bagian tembaga berada di dalam cuka dan bagian lain dari kabel tembaga di luar dari Kaca.
Ujung bebas kabel voltmeter terhubung untuk mengukur gaya elektromotif yang dihasilkan oleh sel sederhana ini. FEM dari jenis sel ini adalah 0,5V. Untuk mencocokkan FEM dari baterai alkali, perlu membangun dua sel lagi dan bergabung dengan tiga dalam seri, sehingga baterai 1.5V diperoleh
Referensi
- Kalimantan, r. Sel galvanik dan elektrolitik. Diperoleh dari: Kelas Quimica.Blogspot.com
- Cedrón, J. Kimia Umum. PUCP. Pulih dari: Korintus.PUCP.Edu.pe
- Farrera, l. Pengantar Elektrokimia. Departemen fisikokimia UNAM. Pulih dari: depa.Fquim.Unam.MX.
- Wikipedia. Sel elektrokimia. Pulih dari: is.Wikipedia.com.
- Wikipedia. Sel galvanik. Pulih dari: is.Wikipedia.com.

