Sifat bersepeda, reaksi, penggunaan, contoh
- 2971
- 225
- Irvin Reichel
Itu Cycloalcanos Mereka adalah keluarga hidrokarbon jenuh dengan formula umum CNH2n Itu bertepatan dengan alkena; dengan perbedaan bahwa tidak jenuh yang jelas bukan karena ikatan rangkap, tetapi cincin atau siklus. Itulah sebabnya mereka dianggap sebagai isomer Alquenos.
Ini terbentuk ketika alkana linier menyatukan ujung rantai mereka untuk berasal dari struktur tertutup. Seperti halnya alkana, cycloalcan dapat menunjukkan berbagai ukuran, massa molekul, substitusi atau bahkan sistem yang terdiri dari lebih dari satu cincin (poliklik).
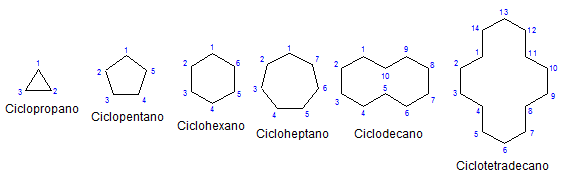
 Beberapa sikloalcanos monosiklik. Sumber: Mephisto Spa via Wikipedia.
Beberapa sikloalcanos monosiklik. Sumber: Mephisto Spa via Wikipedia. Sisanya, kimia dan secara fisik mereka mirip dengan alkana. Mereka hanya memiliki karbon dan hidrogen, mereka adalah molekul netral dan karenanya berinteraksi melalui gaya dinding van der. Mereka juga berfungsi sebagai bahan bakar, melepaskan panas ketika mereka terbakar di hadapan oksigen.
Mengapa sikloalcanos lebih tidak stabil daripada rekan rantai terbuka mereka? Alasannya dapat dicurigai dengan mengamati contoh -contoh sikloalcanos yang diwakili dalam gambar atas: ada ketegangan dan hambatan sterik (spasial).
Perhatikan bahwa semakin sedikit karbon (tercantum dengan warna biru), semakin tertutup strukturnya; Dan yang sebaliknya terjadi ketika mereka meningkat, berbalik seperti kalung.
Cycloalcanos kecil adalah gas, dan karena ukurannya meningkatkan kekuatan antar molekulnya. Akibatnya, mereka dapat berupa cair yang mampu melarutkan lemak dan apolar, pelumas, atau padatan yang terlihat warna gelap dan kualitas seperti warna aspal.
[TOC]
Sifat fisik dan kimia
Polaritas
Ketika hanya terdiri dari karbon dan hidrogen, atom yang tidak terlalu berbeda dalam elektronegativitas, ini membuat molekul sikloalc apolar dan karenanya tidak memiliki momen dipol.
Mereka tidak dapat berinteraksi melalui kekuatan dipol-dipol, tetapi mereka bergantung secara khusus pada kekuatan London, yang lemah tetapi meningkat dengan massa molekul. Itulah sebabnya sikloalcanos kecil (dengan kurang dari lima karbon) adalah gas.
Interaksi antarmolekul
Di sisi lain, karena mereka adalah cincin, sikloalcanos memiliki area kontak yang lebih besar, yang mendukung pasukan London di antara molekul mereka. Dengan demikian, mereka dikelompokkan dan berinteraksi lebih baik dibandingkan dengan alkana; Dan karenanya titik mendidih dan fusi lebih tinggi.
Juga, karena mereka memiliki dua atom hidrogen lebih sedikit (cNH2n Untuk sikloalcanos dan cNH2n+2 Untuk alkana), mereka lebih ringan; Dan menambah ini fakta area kontak terbesarnya, mengurangi volume yang ditempati oleh molekulnya, dan oleh karena itu, mereka lebih padat.
Kejenuhan
Mengapa sikloalcanos sebagai hidrokarbon jenuh diklasifikasikan? Karena mereka memiliki cara mereka menggabungkan molekul hidrogen; Kecuali cincin terbuka, dan dalam hal ini mereka akan menjadi alkana sederhana. Agar hidrokarbon dianggap jenuh, ia harus memiliki jumlah tautan C-H maksimum yang mungkin terjadi.
Itu dapat melayani Anda: potensiometer (fameter)Stabilitas
Secara kimia mereka sangat mirip dengan alkana. Keduanya memiliki tautan C-C dan C-H, yang tidak mudah dipecahkan untuk menyebabkan produk lain. Namun, stabilitas relatif mereka berbeda, yang dapat diverifikasi secara eksperimental dengan mengukur panas pembakaran mereka (ΔHsisir).
Misalnya, bila dibandingkan ΔHsisir Untuk propana dan cyclopropo (diwakili oleh segitiga dalam gambar), masing -masing ada 527,4 kkal/mol dan 498,9 kkal/mol, masing -masing.
Detailnya adalah siklopropanesisir minor (471 kkal/mol) karena mereka adalah tiga gugus metilen, cho2; Namun dalam kenyataannya, ia melepaskan lebih banyak panas, mencerminkan ketidakstabilan yang lebih besar dari perkiraan. Kelebihan energi ini dikatakan karena ketegangan di dalam ring.
Dan pada kenyataannya, ketegangan ini mengatur dan membedakan reaktivitas atau stabilitas sikloalcanos, sehubungan dengan alkana, terhadap reaksi spesifik. Selama ketegangannya tidak terlalu tinggi, sikloalcanos cenderung lebih stabil daripada bagian atasnya masing -masing.
Tata nama
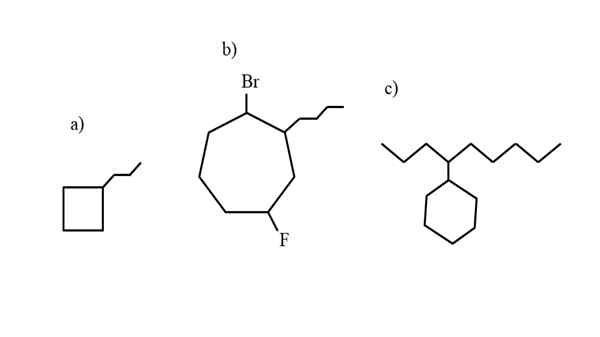 Beberapa contoh cycloalcan tersubstitusi untuk menguji aturan nomenklatur. Sumber: Gabriel Bolívar.
Beberapa contoh cycloalcan tersubstitusi untuk menguji aturan nomenklatur. Sumber: Gabriel Bolívar. Nomenklatur yang diatur oleh IUPAC untuk sikloalcanos tidak terlalu berbeda dari alkana. Aturan paling sederhana dari semua adalah menempatkan awalan siklus- ke nama alkana yang terbentuk oleh sikloalcano.
Jadi, misalnya, dari n-heksana, cho3Ch2Ch2Ch2Ch2Ch3, Cyclohexan diperoleh (diwakili oleh segi enam di gambar pertama). Dengan cara yang sama terjadi dengan siklopropane, cyclobutane, dll.
Sekarang, senyawa ini dapat menderita substitusi dari salah satu hidrogennya. Ketika jumlah karbon cincin lebih tinggi dari substituen sewa, cincin diambil sebagai rantai utama; Ini adalah kasus a) untuk gambar superior.
Perhatikan bahwa dalam a) siklobutan (persegi), memiliki lebih banyak karbon daripada kelompok propilus yang terhubung ke dalamnya; Kemudian senyawa ini dinamai propylciclobutano.
Jika ada lebih dari satu substituen, mereka harus disebutkan dalam urutan abjad dan sedemikian rupa sehingga mereka memiliki nomor locator sesedikit mungkin. Misalnya, b) disebut: 1-bromo-4-fluoro-2-butilcicloheptano (dan bukan 1-bromo-5-fluoro-7-butylcicloheptano, yang akan salah).
Dan akhirnya, ketika substituen alquilis memiliki lebih banyak karbon daripada cincin, dikatakan bahwa yang terakhir adalah kelompok pengganti dari rantai utama. Jadi, c) disebut: 4-cyclohexilnonano.
Dapat melayani Anda: logam oksidaStruktur
Mengesampingkan siklus yang diganti, lebih mudah untuk fokus hanya pada basis struktural mereka: cincin. Ini diwakili dalam gambar pertama.
Saat mengamati mereka, ide yang salah mungkin muncul bahwa molekul seperti itu datar; Tetapi dengan pengecualian cyclopropo, permukaannya adalah "zigzagenantes", dengan karbon turun atau mengunggah sehubungan dengan bidang yang sama.
Ini karena untuk memulai semua karbon memiliki hibridisasi SP3, dan karena itu menyajikan geometri tetrahedral dengan sudut tautan 109,5º. Tetapi, jika geometri cincin diamati dengan cermat, tidak mungkin untuk menjadi sudutnya; Misalnya, sudut dalam segitiga siklopropan adalah 60º.
Inilah yang dikenal sebagai tegangan sudut. Semakin besar cincin, sudut antara tautan C-C lebih dekat ke 109,5º, yang menyebabkan penurunan ketegangan tersebut dan peningkatan stabilitas untuk sikloalcan.
Contoh lain diamati di cyclobutane, yang sudut tautannya adalah 90º. Sudah di siklopentano, sudutnya adalah 108º, dan dari sikloheksan kemudian dikatakan bahwa tegangan sudut berhenti untuk memberikan efek ucapan seperti itu begitu berkomentar.
Konformasi
Selain tegangan sudut, ada faktor -faktor lain yang berkontribusi pada ketegangan yang dialami oleh sikloalcanos.
Tautan C-C tidak dapat berputar tanpa lebih, karena ini akan menyiratkan bahwa seluruh struktur "bergidik". Dengan demikian, molekul -molekul ini dapat mengadopsi konformasi spasial yang sangat baik. Tujuan dari gerakan -gerakan ini adalah untuk mengurangi ketegangan yang disebabkan dalam gerhana atom hidrogen; yaitu, ketika satu di depan yang lain.
Misalnya, konformasi untuk cyclobutane menyerupai kupu -kupu yang mengalahkan sayapnya; orang -orang dari Cyclopentano, sebuah amplop; Orang -orang dari sikloheksan, perahu atau kursi, dan semakin besar cincinnya, semakin besar jumlah dan bentuk yang dapat mereka adopsi di luar angkasa.
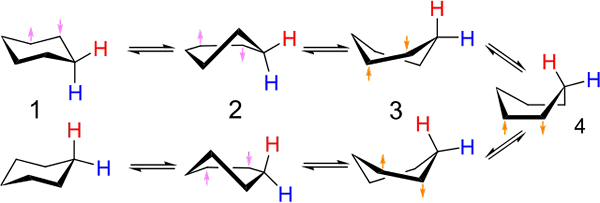 Investasi Antara Ketua dan Konformasi Jenis Kapal untuk Cyclohexane. Sumber: Kministi [CC0].
Investasi Antara Ketua dan Konformasi Jenis Kapal untuk Cyclohexane. Sumber: Kministi [CC0]. Gambar superior menunjukkan contoh konformasi tersebut untuk sikloheksana. Perhatikan bahwa dugaan segi enam datar benar -benar tampak lebih seperti kursi (di sebelah kiri gambar) atau perahu (kanan). Hidrogen diwakili dengan lirik merah, dan satu lagi dengan lirik biru, untuk menunjukkan bagaimana posisi relatif mereka berubah setelah investasi.
Dalam (1), ketika hidrogen tegak lurus terhadap bidang cincin, dikatakan bahwa ia berada dalam posisi aksial; Dan ketika itu sejajar dengan ini, dikatakan bahwa ia berada dalam posisi khatulistiwa.
Reaksi
Reaksi yang dapat diderita sikloalcan sama dengan untuk alkana. Keduanya terbakar di hadapan oksigen berlebih dalam reaksi pembakaran khas untuk menghasilkan karbon dioksida dan air. Demikian juga, keduanya mungkin menderita halogenasi, di mana hidrogen digantikan oleh atom halogen (F, CL, BR, I).
Itu dapat melayani Anda: Keuntungan dan Kekurangan Kimia Kesehatan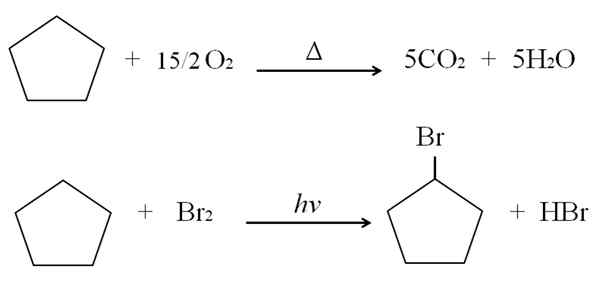 Reaksi siklopentano. Sumber: Gabriel Bolívar.
Reaksi siklopentano. Sumber: Gabriel Bolívar. Di atas reaksi pembakaran dan halogenasi untuk siklopentano ditampilkan sebagai contoh. Satu mol terbakar di hadapan panas dan 7,5 mol oksigen molekul untuk dipecah menjadi CO2 dan H2SALAH SATU. Di sisi lain, di hadapan ultraviolet dan brome.
Aplikasi
Penggunaan sikloalcanos sangat tergantung pada jumlah karbon mereka. Yang paling ringan, dan karenanya gas, pernah berfungsi untuk memberi makan lampu gas dari lampu publik.
Cairan, sementara itu, mendapat keuntungan sebagai pelarut minyak, lemak atau produk komersial yang bersifat apolar. Di antaranya Anda dapat menyebutkan siklopentano, sikloheksan dan sikloheptane. Demikian juga, mereka sering digunakan dalam operasi rutin di laboratorium Petróleos, atau dalam formulasi bahan bakar.
Jika mereka lebih berat, mereka dapat digunakan sebagai pelumas. Di sisi lain, mereka juga dapat mewakili bahan awal untuk sintesis obat; Seperti carboplatin, yang termasuk dalam strukturnya cincin cyclobutane.
Contoh Cychannel
Akhirnya, dikembalikan ke awal artikel: gambar dengan beberapa cycloalcanos yang tidak diganti.
Untuk menghafal cycloalcanos, itu cukup untuk memikirkan figur geometris: segitiga (cyclopropane), persegi (cyclobutane), pentagon (cyclopentano), heksagon.
Semakin besar cincinnya, semakin sedikitnya menyerupai sosok geometris masing -masing. Telah terlihat bahwa cyclohexan adalah segalanya kecuali seekor segi enam; Hal yang sama terjadi lebih jelas dengan cyclootetradecano (empat belas karbon).
Suatu titik datang di mana mereka akan berperilaku seperti kalung yang dapat dilipat untuk mengurangi ketegangan tautan dan gerhana mereka sepenuhnya.
Referensi
- Morrison, r. T. dan boyd, r, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi Keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Libretteks Kimia. (2 Juni 2019). Penamaan Cycloalkanes. Pulih dari: chem.Librettexts.org
- Wikipedia. (2019). Cycloalkane. Diperoleh dari: di.Wikipedia.org
- Clark Jim. (2015). Memperkenalkan Alkaes dan Cycloalkanes. Pulih dari: chemguide.bersama.Inggris
- James Ashenhurst. (2019). Konformasi dan sikloalkanes. Kimia Organik Master. Dipulihkan dari: Masterorganicchemistry.com
- Fernández Germán. (S.F.). Cycloalcanos-toria. Kimia organik. Pulih dari: chemicicaorganica.org

