Struktur kimia asam borat, sifat, persiapan, penggunaan

- 2882
- 786
- Miss Marion Graham
Dia asam borat Itu adalah senyawa anorganik yang formula kimianya h3Bo3. Itu terdiri dari solid putih atau tidak berwarna. Ini adalah asam lemah yang dalam larutan berair menghasilkan, tergantung pada konsentrasinya, pH antara 3,8 dan 4.8. Ini sedikit larut dalam air panas yang dingin dan cukup larut.
Asam borat ditemukan pada 1702 oleh pria Wilhelm.
 Sampel padat asam borat pada kaca jam. Sumber: Walkerma via Wikipedia.
Sampel padat asam borat pada kaca jam. Sumber: Walkerma via Wikipedia. Namun, juga ditunjukkan bahwa boerg menyiapkan asam borat dengan menambahkan air ke boraks dan memanaskan larutan untuk menguapkannya, sehingga meninggalkan sedimen kristal asam krial.
Asam ini adalah senyawa yang sangat berguna yang memiliki banyak aplikasi dalam industri dan kedokteran, juga digunakan sebagai insektisida, pelestarian kayu, memperlambat api dan merupakan konstituen dari larutan redaman pH.
[TOC]
Struktur kimia
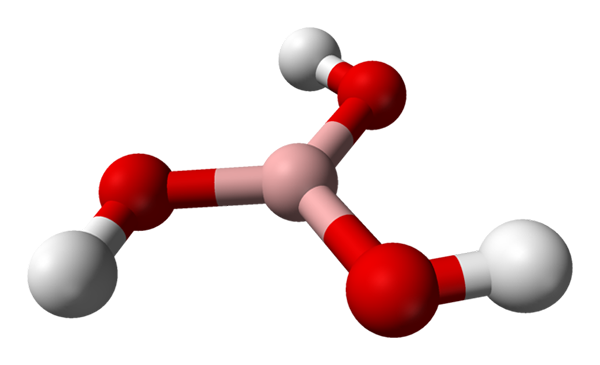 Molekul asam borat diwakili oleh model bola dan batang. Sumber: Benjah-BMM27 [Domain Publik]
Molekul asam borat diwakili oleh model bola dan batang. Sumber: Benjah-BMM27 [Domain Publik] Dalam gambar superior kita memiliki molekul itu sendiri dari h3Bo3. Perhatikan bahwa atom hidrogen, diwakili oleh bola putih, tidak terkait dengan atom boron tengah, seperti yang dapat disarankan formula kimia; melainkan atom oksigen, diwakili oleh bola merah.
Dengan demikian, formula yang lebih nyaman, meskipun kurang digunakan, untuk asam borat adalah B (OH)3, menunjukkan bahwa keasamannya disebabkan oleh ion H+ Dibebaskan dari kelompok OH mereka. Molecula B (OH)3 Ini memiliki geometri datar trigonal, dengan atom boronnya memiliki hibridisasi kimia SP2.
B (oh)3 Ini adalah molekul tinggi kovalen, karena perbedaan elektronegativitas antara atom boron dan oksigen tidak terlalu besar; Jadi tautan B-O pada dasarnya adalah kovalen. Perhatikan bahwa struktur molekul ini menyerupai pemintal. Dapatkah saya menyalakan poros Anda sendiri dengan cara yang sama?
Kristal
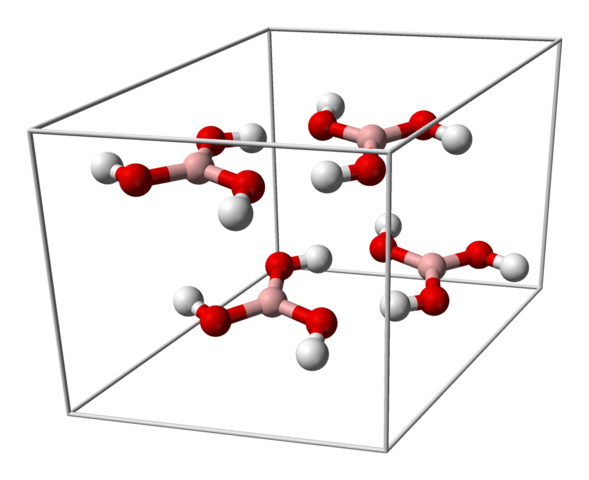 Sel kesatuan untuk kristal H3BO3. Sumber: Benjah-BMM27 [Domain Publik]
Sel kesatuan untuk kristal H3BO3. Sumber: Benjah-BMM27 [Domain Publik] Gambar atas menunjukkan sel kesatuan yang sesuai dengan struktur kristal runcing untuk asam borat yang, dalam kondisi sintesis tertentu, dapat mengadopsi struktur heksagonal yang ringkas. Perhatikan bahwa ada empat molekul per sel kesatuan, dan yang dipesan dalam dua lapisan, A dan B, bergantian (mereka tidak ditumpangkan satu sama lain).
Karena simetri dan bimbingan tautan B-OH, dapat diasumsikan bahwa B (OH)3 Itu apolar; Namun, keberadaan hidrogen antarmolekul menjembatani mengubah sejarah. Masing -masing molekul B (OH)3 Untuk memberikan atau menerima tiga jembatan ini, dengan total enam interaksi dipol-dipolo, seperti yang diamati pada gambar di bawah ini:
Dapat melayani Anda: terpenos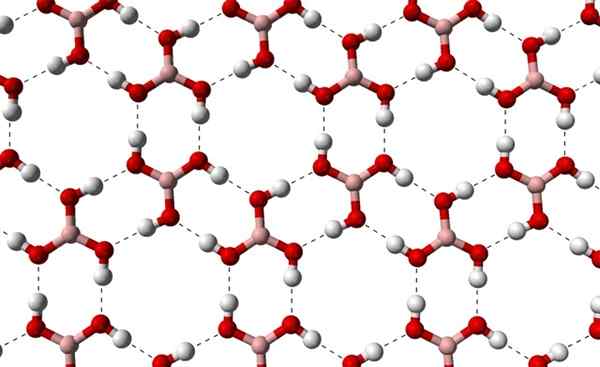 Lapisan kristal H3BO3 diamati dari sumbu yang lebih tinggi. Sumber: Benjah-BMM27 [Domain Publik]
Lapisan kristal H3BO3 diamati dari sumbu yang lebih tinggi. Sumber: Benjah-BMM27 [Domain Publik] Perhatikan bahwa jembatan hidrogen ini adalah interaksi terarah yang mengatur kristal asam borat, dan menetapkan pola aspek hias; Cincin internal mungkin dengan ruang yang cukup untuk menyumbat beberapa kotoran yang tidak dalam cacat kristal.
Jembatan hidrogen ini, meskipun massa molekul rendah B (OH)3, Mereka menjaga kohesif kaca mereka cukup sehingga dia membutuhkan suhu 171 ºC untuk meleleh. Tidak diketahui efek apa yang akan memiliki tekanan tinggi (dalam urutan GPa) pada lapisan molekul B (OH)3.
Properti
Nama
IUPAC: asam borat dan trihidrooksidobor. Nama Lain: Asam Orthoboric, Asam Borrasik, Sassolite, Borofax dan Trihydroxiborano.
Masa molar
61.83 g/mol
Penampilan fisik
Solid putih kristal, tidak berwarna dan transparan. Itu juga dicapai sebagai butiran atau dalam bentuk debu putih. Sedikit tidak berbahaya untuk disentuh.
Bau
WC
Rasa
Sedikit pahit
Titik lebur
170.9 ºC
Titik didih
300 ºC
Kelarutan air
Sedang larut dalam air dingin dan larut dalam air panas:
2.52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
Asam borat sebagian larut dalam air dan cenderung tenggelam ke dalamnya. Kelarutan ini cenderung meningkatkan adanya asam, seperti hidroklorik, sitrat dan tartaric.
Kelarutan dalam pelarut lain
-Gliserol: 17,5 % pada 25 ° C
-Ethylene Glycol: 18,5 % pada 25 ° C
-Aseton: 0,6 % pada 25 ° C
-Etil asetat: 1,5 % pada 25 ° C
-Metanol: 172 g/l a 25 ºC
-Etanol: 94,4 g/l A 25 ºC
Koefisien Partisi Octanol/Air
Log p = -0.29
Keasaman (PKA)
9.24. 12.4. 13.3. Ini adalah tiga konstanta dari disosiasi masing -masing untuk melepaskan h+ Di dalam air.
ph
3.8 - 4,8 (3,3 % dalam larutan berair)
5.1 (0,1 molar)
Tekanan uap
1.6 · 10-6 MMHG
Stabilitas
Stabil di air
Penguraian
Itu rusak saat dipanaskan di atas 100 ºC, membentuk borik anhidrida dan air.
Reaktivitas
Asam Borat bentuk garam larut dengan kation monovalen, misalnya: NA2B4SALAH SATU7.10h2Atau, dan garam yang tidak larut dengan kation divalen, taksi4SALAH SATU7.6h2SALAH SATU.
Dalam larutan berair itu menghasilkan larutan asam, berpikir bahwa sifat ini disebabkan oleh pengurangan gugus OH- air. Asam borat memenuhi syarat sebagai asam lemah dari tipe Lewis.
Asam borat bereaksi dengan gliserol dan manitol, meningkatkan keasaman lingkungan berair. PKA dimodifikasi dari 9,2 menjadi 5, karena pembentukan boro-manitol quelato [bc6H8SALAH SATU2(OH)2]-, yang melepaskan h+.
Persiapan
Asam borat berada dalam keadaan bebas dalam emanasi gunung berapi di daerah seperti Tuscany of Italia, Kepulauan Lipari dan di Negara Bagian Nevada, AS. Ini juga ditemukan dalam mineral seperti Borax, Boracita, Ulexita dan Colemanita.
Dapat melayani Anda: halogenAsam borat terutama disiapkan dengan reaksi mineral Borax (natrium natrium tetraborat) dengan asam mineral, seperti asam klorida, asam sulfat, dll.
Na2B4SALAH SATU9· 10h2O +hcl => 4 jam3Bo3 + 2 NaCl +5 H2SALAH SATU
Ini juga disiapkan melalui hidrolisis Boro dan Diborano Trihaluro.
Asam borat dibuat dari collemanite (CA2B6SALAH SATUsebelas· 6 h2SALAH SATU). Prosedur ini terdiri dalam pengobatan mineral dengan asam sulfat untuk melarutkan senyawa boron.
Kemudian, larutan di mana asam borat dari fragmen yang tidak dipisahkan dipisahkan. Larutan hidrogen sulfida diperlakukan untuk memicu kotoran arsenik dan zat besi. Supernatan didinginkan untuk menghasilkan endapan asam borat dan memisahkannya dari suspensi.
Aplikasi
Di industri
Asam borat digunakan dalam elaborasi fiberglass. Dengan berkontribusi untuk mengurangi titik leleh, ini meningkatkan kekuatan dan efisiensi fiberglass tekstil: bahan yang digunakan untuk memperkuat plastik yang digunakan dalam pembuluh, pipa industri, dan pelat sirkuit komputer.
Asam borat berpartisipasi dalam pembuatan kaca borosilisasi, yang memungkinkan mendapatkan kaca tahan kaca, dapat digunakan dalam masakan rumah tangga, dalam bahan gelas laboratorium, tabung fluoresen, serat optik, layar LCD, dll.
Ini digunakan dalam industri metalurgi untuk mengeraskan dan mengobati paduan baja, serta mendukung lapisan logam bahan.
Ini digunakan sebagai komponen kimia dalam fraktur hidrolik (fracking): Metode yang digunakan dalam ekstraksi minyak dan gas. Asam borat bertindak sebagai penghambat api dalam bahan selulosa, plastik dan tekstil yang diresapi dengan asam borat untuk meningkatkan ketahanan api mereka.
Dalam kedokteran
Asam borat digunakan diencerkan dalam pencucian mata. Kapsul gelatin asam borat digunakan untuk pengobatan infeksi jamur, terutama Candida albicans. Itu juga telah digunakan dalam pengobatan jerawat.
Asam borat ditaburkan dalam kaus kaki untuk mencegah infeksi kaki, seperti kaki atlet. Demikian juga, larutan yang mengandung asam borat digunakan dalam pengobatan otitis eksternal pada manusia, serta pada hewan.
Asam borat ditambahkan dalam botol yang digunakan untuk pengumpulan urin, yang mencegah kontaminasi bakteri sebelum diperiksa di laboratorium diagnostik.
Itu dapat melayani Anda: asam indolaletat: struktur, sifat, mendapatkan, menggunakanInsektisida
Asam borat digunakan dalam kontrol proliferasi serangga, seperti kecoak, rayap, semut, dll. Kecoa tidak langsung membunuh secara instan, karena pertama kali mempengaruhi sistem pencernaan dan sarafnya, selain menghancurkan exoskeletonnya.
Asam borat mengerahkan aksinya secara perlahan, memungkinkan serangga yang telah mencernanya untuk bersentuhan dengan serangga lain, sehingga menyebarkan keracunan.
Kelestarian
Asam borat digunakan untuk mencegah serangan kayu oleh jamur dan serangga, menggunakan untuk tujuan ini bersama dengan etilen glikol. Perawatan ini juga efektif dalam mengendalikan lumpur dan ganggang.
PH Shock Absorber
Asam Borat dan basa terkonjugasi membentuk sistem redaman PKA = 9,24, yang menunjukkan bahwa penyerap kejut ini memiliki efektivitas terbesar terhadap pH alkali, yang tidak biasa pada makhluk hidup. Namun, penyerap kejut borato digunakan dalam regulasi pH di kolam.
Reaktor nuklir
Asam borat memiliki kemampuan untuk menangkap neutron termal, yang mengurangi kemungkinan fisi nuklir yang tidak dikontrol yang dapat menghasilkan kecelakaan nuklir.
Pertanian
Boro adalah elemen penting untuk pertumbuhan tanaman, yang menginduksi penggunaan asam borat untuk kontribusi elemen. Namun, dalam asam borat berlebih dapat merusak tanaman, terutama buah jeruk.
Kontraindikasi
Penggunaan asam borat pada kulit yang digelek. Ini adalah senyawa beracun di dalam tubuh dan dalam beberapa kasus, dapat menyebabkan pingsan, kejang, kejang, tic wajah dan hipotensi arteri.
Dokter harus dikonsultasikan untuk penggunaan kapsul vagina asam borat pada wanita hamil, karena telah ditunjukkan bahwa deformasi janin dan penurunan berat badan anak saat lahir dapat menghasilkan saat lahir.
Penempatan asam borat, digunakan sebagai insektisida, di tempat -tempat yang tersedia untuk anak -anak, karena anak -anak memiliki kerentanan yang lebih besar terhadap aksi toksik asam borat, menetapkan di dalamnya dosis fatal pada 2.000 hingga 3.000 mg.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). ASAM BORAT. Diperoleh dari: di.Wikipedia.org
- Pusat Nasional Informasi Bioteknologi. (2019). ASAM BORAT. Database pubchem. CID = 7628. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Para editor Eeritlopaedia Britannica. (28 Maret 2019). ASAM BORAT. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Operator bergetar. (9 November 2018). Uses asam birik tersembunyi dalam kehidupan sehari -hari Anda. Pulih dari: carriervibrating.com
- Pusat Informasi Pestisida Nasional. (S.F.). ASAM BORAT. Pulih dari: npic.Orst.Edu
- Penyusunan. (30 November 2017). Asam Borat: Sifat dan Penggunaan Senyawa Kimia ini. Diperoleh dari: asam.Info
- Klorurosodium. (2019). Asam borat. Pulih dari: chlorurosodium.com
- Masyarakat Farmasi Rumah Sakit Spanyol. (S.F.). Asam borat. [PDF]. Diperoleh dari: kelompok pekerjaan.Sefh.adalah
- « Pembanding optik apa penggunaan dan bagian
- 11 Manfaat Daur Ulang Dalam Masyarakat (dengan Contoh) »

