Asam karboksilat
- 4628
- 1202
- Jessie Harvey
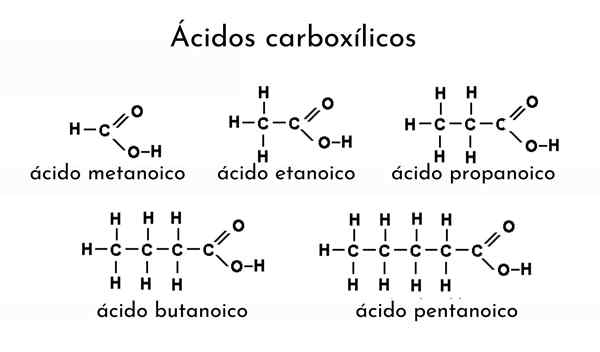
 Contoh asam karboksilat
Contoh asam karboksilat Apa itu asam karboksilat?
Dia asam karboksilat Ini adalah istilah yang disebabkan oleh senyawa organik yang mengandung kelompok karboksil. Mereka juga dapat disebut asam organik, dan ada di banyak sumber alami. Misalnya, dari semut dan serangga lain seperti kumbang galerit, asam format, asam karboksilat disuling.
Yaitu, semut adalah sumber yang kaya akan asam format. Juga, asam asetat diekstraksi dari cuka, bau mentega tengik disebabkan oleh asam butirat, herbal valeria mengandung asam otak dan dari tutup yang diperoleh asam capric, semua asam karboksilat ini.
Asam laktat memberikan rasa susu asam yang buruk, dan pada beberapa lemak dan minyak asam lemak hadir. Contoh -contoh sumber alami asam karboksilat tak terhitung banyaknya, tetapi semua nama yang ditugaskan berasal dari kata -kata dalam bahasa Latin. Jadi, dalam bahasa Latin kata itu Formica berarti "semut".
Karena asam -asam ini diekstraksi dalam berbagai bab sejarah, nama -nama ini umum, konsolidasi dalam kultur populer.
Rumus
Itu Formula umum asam karboksilat adalah -r -cooh, atau lebih detail: R- (c = o) -oh. Atom karbon terkait dengan dua atom oksigen, yang menyebabkan penurunan kepadatan elektroniknya dan, akibatnya, beban parsial positif.
Beban ini mencerminkan status oksidasi karbon dalam senyawa organik. Di lain, karbon sama berkaratnya dengan asam karboksilat, oksidasi ini sebanding dengan tingkat reaktivitas senyawa yang menjadi.
Karena alasan ini kelompok -COOH memiliki dominasi terhadap kelompok organik lainnya, dan mendefinisikan sifat berkarbonasi utama dan rantai karbon utama senyawa.
Oleh karena itu, tidak ada turunan asam amina (R-NH2), tetapi amino yang berasal dari asam karboksilat (asam amino).
Tata nama
Nama umum yang berasal dari Latin untuk asam karboksilat tidak mengklarifikasi struktur senyawa, atau pengaturan atau disposisi kelompok atomnya.
Mengingat kebutuhan akan klarifikasi ini, nomenklatur sistematis IUPAC muncul untuk menamai asam karboksilat.
Dapat melayani Anda: bromin: riwayat, struktur, konfigurasi elektronik, properti, penggunaanNomenklatur ini diatur oleh beberapa aturan, dan beberapa di antaranya adalah:
Aturan 1
Untuk menyebutkan asam karboksilat, nama alkana harus dimodifikasi dengan menambahkan akhiran "ICO". Jadi, untuk etana (pilih3-Ch3) Asam karboksilat yang sesuai adalah asam etanoat (CH3-COOH, asam asetat, sama dengan cuka).
Contoh Lain: Untuk Cho3Ch2Ch2-Cooh el alcano menjadi butana (ch3Ch2Ch2Ch3) dan, oleh karena itu, asam butanoat (asam butirat, sama dengan mentega tengik) ditunjuk.
Aturan 2
Kelompok -COOH mendefinisikan rantai utama, dan jumlah yang sesuai dengan masing -masing karbon dihitung dari karbonil.
Misalnya, Cho3Ch2Ch2Ch2-COOH adalah asam pentanoat, menghitung dari satu hingga lima karbon ke metil (pilih3). Jika kelompok metil lain terkait dengan karbon ketiga, itu akan menjadi cho3Ch2Ch (ch3) Ch2-COOH, menjadi nomenklatur yang dihasilkan sekarang: asam 3-metilpentanoat.
Aturan 3
Substituen didahului oleh jumlah karbon yang dihubungkan. Demikian juga, substituen ini dapat berupa tautan ganda atau tiga, dan menambahkan sufiks "ICO" secara setara dengan alkena dan alkine. Misalnya, Cho3Ch2Ch2Ch = chch2-COOH disebut sebagai asam (cis atau trans) 3- heptenoic.
Aturan 4
Saat rantai R terdiri dari cincin (φ). Asam disebutkan dimulai dengan nama cincin dan berakhir dengan akhiran "karboksilat". Misalnya, φ-cooh dinamai sebagai asam benzecenocarboxylic.
Struktur asam karboksilat
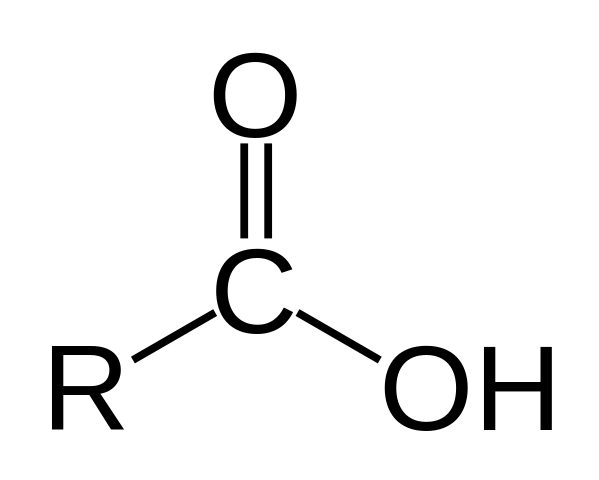 Struktur asam karboksilat. R adalah rantai hidrogen atau berkarbonasi.
Struktur asam karboksilat. R adalah rantai hidrogen atau berkarbonasi. Pada gambar atas struktur umum asam karboksilat diwakili. Rantai samping r bisa panjangnya atau memiliki semua jenis substituen.
Atom karbon memiliki hibridisasi SP2, yang memungkinkan Anda untuk menerima ikatan rangkap dan menghasilkan sudut tautan sekitar 120º.
Oleh karena itu, grup ini dapat berasimilasi sebagai segitiga datar. Oksigen atas kaya akan elektron, sedangkan hidrogen yang lebih rendah buruk pada elektron, menjadi hidrogen asam (akseptor elektron). Ini dapat diamati dalam struktur resonansi ikatan rangkap.
Hidrogen ditugaskan untuk basa, dan untuk alasan ini struktur ini sesuai dengan senyawa asam.
Dapat melayani Anda: aminaSifat asam karboksilat
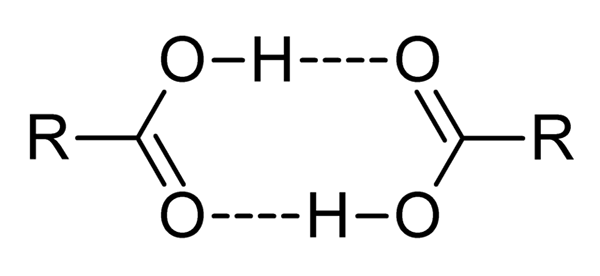
Asam karboksilat adalah senyawa yang sangat polar, bau yang kuat dan dengan kemudahan berinteraksi secara efektif satu sama lain dengan jembatan hidrogen, seperti yang diilustrasikan oleh gambar yang unggul.
Ketika dua asam karboksilat berinteraksi dengan cara ini, Dímeros terbentuk, beberapa stabil cukup untuk ada dalam fase gas.
Jembatan hidrogen dan diameter menyebabkan asam karboksilat memiliki titik didih yang lebih tinggi daripada air. Ini karena energi yang disediakan dalam panas harus menguap tidak hanya molekul, tetapi untuk dimer, juga dihubungkan oleh jembatan hidrogen ini.
Asam karboksilat kecil merasakan afinitas yang besar untuk pelarut air dan kutub. Namun, ketika jumlah atom karbon lebih besar dari empat, karakter hidrofobik rantai R mendominasi dan menjadi tidak terlihat dengan air.
Dalam fase padat atau cair, panjang rantai R dan substituen yang dimilikinya memainkan peran penting. Jadi, ketika rantai sangat panjang, mereka berinteraksi satu sama lain melalui kekuatan dispersi London, seperti dalam kasus asam lemak.
Keasaman
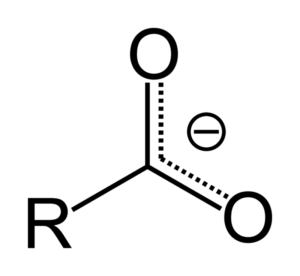
Saat asam karboksilat menyumbangkan proton, itu menjadi anion karboksilat, diwakili dalam gambar atas. Dalam anion ini, beban negatif dipindahkan antara dua atom karbon, menstabilkannya dan, oleh karena itu, mendukung reaksi yang terjadi.
Seberapa bervariasi keasaman ini dari satu asam karboksilat lainnya? Itu semua tergantung pada keasaman proton dalam kelompok OH: semakin miskin dalam elektron, semakin banyak asam.
Keasaman ini dapat ditingkatkan jika salah satu substituen rantai RA adalah spesies elektronegatif (yang menarik atau menarik kepadatan elektronik dari lingkungannya).
Misalnya, jika di Cho3-COOH diganti dengan kelompok metil dengan atom fluor (CFH2-COOH) Keasaman meningkat pesat karena f menarik kepadatan elektronik dari karbonil, oksigen, dan kemudian hidrogen. Jika semua h digantikan oleh f (cf3-COOH) Keasaman mencapai nilai maksimumnya.
Dapat melayani Anda: Hidrogen: Sejarah, Struktur, Sifat dan PenggunaanVariabel apa yang menentukan tingkat keasaman? PKke. Semakin rendah PKke Dan lebih dekat ke 1, lebih besar adalah kemampuan asam untuk dipisahkan dalam air dan, pada gilirannya, lebih berbahaya dan berbahaya. Dari contoh sebelumnya, CF3-COOH memiliki nilai PK terendahke.
Penggunaan/aplikasi asam karboksilat
Karena variasi asam karboksilat yang sangat besar, masing -masing memiliki aplikasi potensial dalam industri, baik polimer, farmasi atau makanan.
Industri makanan
- Aditif.
- Pengawet (asam sorbat dan asam benzoat).
- Regulator alkalinitas dari banyak produk.
- Produksi minuman ringan.
- Agen antimikroba sebelum aksi antioksidan. Dalam hal ini, trennya adalah antimikroba cair.
- Bahan utama cuka umum (asam asetat).
- Asidulan dalam minuman berkarbonasi dan makanan (asam sitrat dan asam laktat).
- Asisten dalam Pematangan Keju Swiss (Asam Propionat).
- Keju, chucrut, colm fermentasi dan minuman ringan (asam laktat).
Industri farmasi
- Antipyretic dan Analgesic (Asam Asetilsalisilat).
- Aktif dalam proses sintesis aroma, dalam beberapa obat (butirik atau asam butanoat).
- Antimicotic (asam benzoat dikombinasikan dengan asam salisilat).
- Aktif untuk pembuatan obat -obatan vitamin C (asam askorbat).
- Fungisida (asam caprilic).
- Pembuatan beberapa pencahar (asam hidroksibotanodium).
Industri lain
- Pembuatan plastik dan pelumas (asam sorbat).
- Pembuatan pernis, resin elastis dan perekat transparan (asam akrilat).
- Pembuatan lukisan dan pernis (asam linoleat).
- Pembuatan sabun, deterjen, sampo, kosmetik dan produk pembersih logam (asam oleat).
- Pembuatan pasta gigi (asam salisilat).
- Produksi Rayon Acetate, Film Fotografi dan Pelarut untuk Cat (Asam Asetat).
- Produksi pewarna dan kecokelatan (asam metana).
- Persiapan minyak pelumas, bahan tahan air, dan lukisan sekte (asam palmitat).
- Pembuatan karet (asam asetat).
- Elaborasi karet dan galvanoplasti.
- Pelarut.
- Produksi Parfum (Asam Benzoat).
- Pembuatan plasticizer dan resin (asam fotal).
- Elaborasi poliester (asam tereftallic).
- Persiapan lilin parafin (asam stearat).
Referensi
- Graham Solomons t.W., Craig b. Fryhle. Kimia organik. Asam karboksilat dan turunannya (edisi ke -10., Halaman 779-783). Wiley Plus.
- Asam organik. NaturalWellbeing pulih.com
- Francis a. Tortoiseshell. Kimia organik. Asam karboksilat. (Edisi Keenam., Halaman 805-820). MC Graw Hill.
- William Reusch. Asam karboksilat. Pulih dari kimia.MSU.Edu

