Asam fosfor (H3PO3)
- 1251
- 358
- Tommie Smith
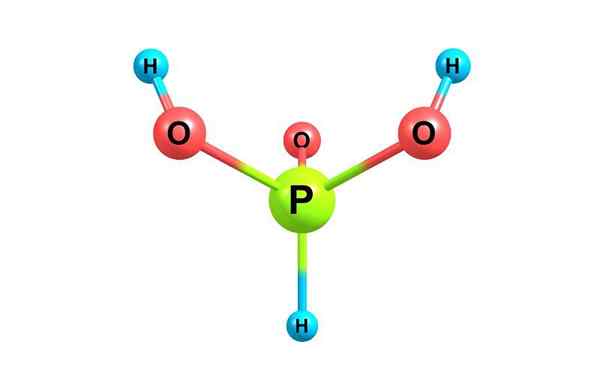
 Struktur kimia asam fosfor. Dengan lisensi
Struktur kimia asam fosfor. Dengan lisensi Apa itu asam fosfor?
Dia Asam fosfor, Juga disebut asam ortofosfat, itu adalah senyawa kimia dari formula H3PO3. Ini adalah salah satu dari berbagai asam teroksigenasi fosfor dan strukturnya disajikan pada gambar atas.
Mengingat formula senyawa, ini dapat ditulis ulang sebagai HPO (OH)2. Spesies ini ada seimbang dengan tautomer kecil P (OH)3.
Rekomendasi IUPAC, 2005, adalah bahwa yang terakhir disebut asam fosfor, sedangkan bentuk dihidroksi disebut asam fosfonat. Hanya berkurangnya senyawa fosfor adalah mantra dengan penghentian "beruang".
Asam fosfor adalah asam diprotik, ini berarti bahwa ia hanya memiliki kemampuan untuk menghasilkan dua proton. Ini karena mayoritas tautomer adalah h3PO3.
Saat bentuk ini kehilangan proton, resonansi menstabilkan anion yang terbentuk. P (OH) Tautomero 3 tidak memiliki manfaat stabilisasi resonansi. Ini membuat penghapusan proton ketiga jauh lebih sulit.
Asam fosfat (h3PO3) Penjualan yang disebut fosfit, yang digunakan sebagai agen peredam. Disiapkan dengan melarutkan heksoksida tetraphosfor (p4SALAH SATU6) Menurut persamaan:
P4SALAH SATU6 + 6 H₂O → 4 HPO (OH)2
Asam fosfor murni, h3PO3, Lebih disiapkan dengan hidrolisis fosfor triklorida, PCL3.
Pcl3 + 3H2O → HPO (OH)2 + 3hcl
Larutan yang dihasilkan dipanaskan untuk mengeluarkan HCl, dan air yang tersisa menguap sampai muncul 3PO3 kristal berwarna saat pendingin. Asam juga dapat diperoleh dengan aksi air pada PBR3 atau pi3.
Sifat fisik dan kimia dari Asam fosfor
- Asam fosfor adalah kristal tetrahedral higroskopis putih atau kuning, dengan aroma yang mirip dengan bawang putih.
Dapat melayani Anda: solusi tak jenuh- H3PO3 Ini memiliki berat molekul 82,0 g/mol dan kepadatan 1.651 g/ml.
- Senyawa ini memiliki titik leleh 73 ° C dan terurai di atas 200 ° C.
- Itu larut dalam air, mampu melarutkan 310 gram per 100 ml pelarut ini. Itu juga larut dalam etanol.
- Ini adalah asam yang kuat dengan PKA antara 1,3 dan 1.6.
- Pemanasan asam fosfor pada sekitar 200 ° C membuatnya tidak proporsi pada asam fosfat dan fosfin (pH3). Fosfin adalah gas yang biasanya menyala secara spontan di udara.
4H3PO3 + Panas → Ph3 + 3H3PO4
Reaktivitas dan bahaya
Reaktivitas
- Asam fosfor bukan senyawa yang stabil.
- Menyerap oksigen udara untuk membentuk asam fosfat.
- Bentuk endapan kuning dalam larutan berair yang mudah terbakar saat pengeringan.
- Bereaksi secara eksotermis dengan basis kimia (misalnya: amina anorganik dan hidroksida) untuk membentuk garam.
- Reaksi ini dapat menghasilkan panas dalam jumlah besar di ruang kecil.
- Pembubaran air atau pengenceran larutan terkonsentrasi dengan air tambahan dapat menghasilkan panas yang signifikan.
- Bereaksi dengan adanya kelembaban dengan logam aktif, termasuk logam struktural seperti aluminium dan besi, untuk melepaskan hidrogen, gas yang mudah terbakar.
- Anda dapat memulai polimerisasi alkena tertentu. Bereaksi dengan senyawa sianida untuk melepaskan sianida hidrogen gas.
- Ini dapat menghasilkan gas yang mudah terbakar dan / atau beracun yang bersentuhan dengan ditiokarbamat, isokianat, pedagang, nitrida, nitril, sulfida dan agen pereduksi yang kuat.
- Reaksi pembangkit gas tambahan diproduksi dengan sulfit, nitrit, tiosulfat (untuk memberikan H2S dan SO3), dionitos (untuk memberikan SO2) dan karbonat (untuk memberikan CO₂).
Itu dapat melayani Anda: einstenio: struktur, properti, memperoleh, penggunaanBahaya
- Senyawa ini korosif untuk mata dan kulit.
- Kontak mata dapat mengakibatkan kerusakan atau kebutaan kornea.
- Kontak kulit dapat menghasilkan peradangan dan lepuh.
- Penghirupan debu akan menghasilkan iritasi pada saluran pencernaan atau pernapasan, ditandai dengan pembakaran, bersin dan batuk.
- Eksposur berlebih yang parah dapat menyebabkan kerusakan paru -paru, mati lemas, kehilangan pengetahuan atau kematian.
Tindakan jika terjadi kerusakan
- Pastikan bahwa staf medis mengetahui materi yang terlibat dan mengambil tindakan pencegahan untuk melindungi diri mereka sendiri.
- Korban harus dipindahkan ke situs baru dan menghubungi layanan medis darurat.
- Napas buatan harus diberikan jika korban tidak bernafas.
- Metode mulut ke mulut tidak boleh digunakan jika korban telah mencerna atau menghirup zat tersebut.
- Pernapasan buatan dilakukan dengan bantuan masker saku yang dilengkapi dengan katup searah atau perangkat pernapasan yang memadai lainnya.
- Oksigen harus diberikan jika bernafas sulit.
- Pakaian dan sepatu yang terkontaminasi harus dilepas dan diisolasi.
- Dalam hal kontak dengan zat, bilas kulit atau mata segera dengan air mengalir setidaknya selama 20 menit.
- Untuk kontak kulit yang lebih rendah, bahan tersebut harus dihindari pada kulit tanpa kemampuan.
- Jaga agar korban tetap tenang dan panas.
- Efek paparan (inhalasi, konsumsi atau kontak kulit) dapat ditunda.
Penggunaan Asam fosfor
- Penggunaan asam fosfor terpenting adalah produksi fosfit yang digunakan dalam pengolahan air. Asam fosfat juga digunakan untuk menyiapkan garam fosfit, seperti kalium fosfit.
Dapat melayani Anda: Hukum Boyle- Fosfit telah menunjukkan kemanjuran dalam kontrol berbagai tanaman.
- Secara khusus, pengobatan dengan injeksi batang atau daun, yang mengandung garam asam fosfor, diindikasikan sebagai respons terhadap infeksi karena patogen tanaman phytoftera dan tipe pythium (menghasilkan dekomposisi akar).
- Asam fosfor dan fosfit digunakan sebagai agen pereduksi dalam analisis kimia. Sintesis asam fenilasetat yang nyaman dan terukur baru, melalui reduksi yang dikatalisis oleh asam mandelat iodida, didasarkan pada generasi in -sitter asam iodidekik dari katalitik natrium iodida katalitik iodida katalitik. Untuk ini, asam fosfat digunakan sebagai peredam stoikiometrik.
- Ini digunakan sebagai bahan untuk produksi aditif yang digunakan dalam industri poli (vinil klorida). Juga ester asam fosfor digunakan dalam beberapa reaksi sintesis organik.
Referensi
- Asam fosfor (H3PO3). Pulih dari Britannica.com.
- Asam Mushonic. Pulih dari EBI.Ac.Inggris.

