Asam Fosfat (H3PO4)
- 3932
- 419
- Miss Marion Graham
 Molekul asam fosfat individu
Molekul asam fosfat individu Apa itu asam fosfat?
Dia Asam fosfat Ini adalah asam oxo dari fosfor yang memiliki formula kimia H3PO4. Ini terdiri dari asam mineral di mana tiga proton asam terkait dengan anion fosfat (PO43-). Meskipun tidak dianggap sebagai asam yang kuat, penggunaannya yang tidak tepat mungkin memiliki risiko kesehatan.
Dapat ditemukan di dua negara: sebagai padatan dalam bentuk kristal ortorombik tebal, atau sebagai cairan penampilan sirup kristal. Presentasi komersialnya yang paling umum memiliki konsentrasi 85% P/P dan kepadatan 1.685 g/cm3. Kepadatan ini berasal dari tangan konsentrasi.
Tiga kelompok OH bertanggung jawab untuk menyumbangkan hidrogen asam. Karena kehadiran mereka dalam struktur mereka, Anda dapat bereaksi dengan hidroksida yang berbeda yang menyebabkan beberapa garam.
Dalam kasus natrium hidroksida, Anda dapat membentuk tiga: natrium fosfat monobasik (nah2PO4), Dibasic Sodium Phosphate (NA2HPO4) dan natrium fosfat tribasic (NA3PO4).
Namun, tergantung pada basis mana yang digunakan untuk netralisasi, atau kation apa yang sangat dekat dengannya, Anda dapat membentuk garam fosfat lainnya. Di antara mereka adalah: kalsium fosfat (CA3(PO4)2), Lithium fosfat (li3PO4), ferrik fosfat (fepo4), dan lain-lain. Masing -masing dengan tingkat protonasi anion fosfat yang berbeda.
Di sisi lain, asam fosfat dapat "menculik" kation divalen seperti iman2+, Cu2+, Ac2+ dan mg2+. Pada suhu tinggi Anda dapat bereaksi dengan diri sendiri dengan kehilangan molekul H2Atau membentuk diameter, pemangkas dan polimer asam fosfat.
Jenis reaksi ini membuat senyawa ini mampu membangun sejumlah besar struktur dengan fosfor dan kerangka oksigen, dari mana berbagai garam yang diketahui juga dapat diperoleh, seperti polifosfat.
Mengenai penemuannya, ia disintesis pada tahun 1694 oleh Robert Boyle (1627-1691), melarutkan P2SALAH SATU5 (Fosfor pentoksida) dalam air. Ini adalah salah satu asam mineral yang paling berguna, menjadi fungsinya sebagai pupuk yang paling penting.
Fosfor, kalium dan nitrogen merupakan tiga nutrisi utama tanaman.
Struktur asam fosfat kimia
 Struktur asam fosfat kimia
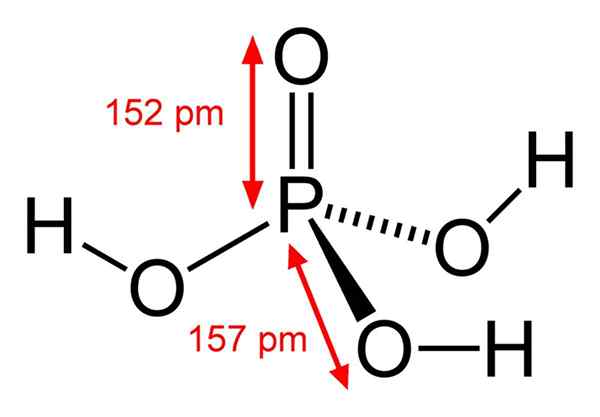
Struktur asam fosfat kimia Asam fosfat terdiri dari ikatan P = O. Dengan atom fosfor di tengah, oksigen menggambar sejenis tetrahedron molekul.
Dengan cara ini, asam fosfat dapat divisualisasikan sebagai tetrahedron. Dari perspektif ini tetrahedra ini (dengan unit h3PO4) berinteraksi satu sama lain dengan jembatan hidrogen; yaitu, simpul mereka mendekati.
Interaksi antar molekul ini memungkinkan kristal asam fosfat dalam dua padatan: anhidrat dan hemihidrat (h3PO4· 1/2h2O), keduanya dengan sistem kristal monoklinik. Bentuk anhidranya juga dapat dijelaskan dengan rumus: 3h2Atau · p2SALAH SATU5, yang sama dengan fosfor pentoksida tri-hidrasi.
Tetrahedra bahkan dapat menghubungkan secara kovalen, tetapi untuk ini unitnya harus menghilangkan molekul air melalui dehidrasi. Ini terjadi saat h3PO4 Ini mengalami pemanasan, dan menghasilkan konsekuensi pembentukan asam polifosfer (PA).
Asam diposforik (h4P2SALAH SATU7)
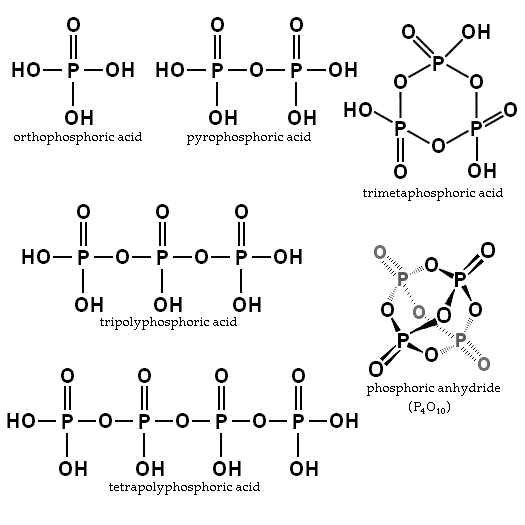
Yang paling sederhana dari semua PA adalah asam diposforik (h4P2SALAH SATU7), juga dikenal sebagai asam pirofosfat. Persamaan kimia formasi Anda adalah sebagai berikut:
Itu dapat melayani Anda: aluminium fosfat (alpo4): struktur, sifat, mendapatkan, menggunakan2h3PO4 H4P2SALAH SATU7 + H2SALAH SATU
Keseimbangan tergantung pada jumlah air dan suhu. Apa strukturnya? Pada gambar bagian, struktur asam ortofosfah dan asam pirofosfat diilustrasikan di sudut kiri atas.
Dua unit bergabung secara kovalen saat molekul air dihilangkan, membentuk jembatan oksigen p-o-p di antara mereka. Sekarang mereka bukan tiga hidrogen asam, tetapi empat (empat kelompok -oh). Karena ini, h4P2SALAH SATU7 menyajikan empat konstanta kke.
Asam polifosfat
Dehidrasi dapat berlanjut dengan asam pirofosfat jika pemanasan berlanjut. Karena? Karena di setiap ujung molekulnya ada kelompok OH yang dapat dihilangkan sebagai molekul air, sehingga mempromosikan pertumbuhan kerangka p-o-o-o-p ... p ..
Contoh asam ini adalah asam trimfosfor dan tetropolifforik (keduanya juga diilustrasikan dalam gambar sebelumnya). Dapat dilihat bagaimana kerangka P-O-P memperpanjang dalam semacam rantai yang dibentuk oleh Tetrahedra.
Senyawa ini dapat diwakili dengan formula HO (PO2OH)XH, di mana ho adalah ujung kiri yang bisa mengalami dehidrasi. PO2OH adalah kerangka fosfor dengan tautan P = O dan OH; Dan x adalah unit asam fosfat atau molekul yang diperlukan untuk mendapatkan rantai tersebut.
Ketika senyawa ini sepenuhnya dinetralkan, polifosfat yang disebut SO. Tergantung kation mana yang dikelilingi, mereka membentuk berbagai macam garam polifosfat.
Di sisi lain, jika mereka bereaksi dengan alkohol ROH, hidrogen kerangka mereka digantikan oleh substituen alkil r-. Dengan demikian, ester fosfat (atau polifisis) muncul: ro (po2Atau)XR. Itu cukup untuk menggantikan h dengan r semua struktur gambar bagian untuk mendapatkannya.
Asam polifosfat siklik
Rantai P-O-P bahkan dapat ditutup dalam cincin atau siklus fosfor. Yang paling sederhana dari jenis senyawa ini adalah asam trimethaphorc (sudut kanan atas gambar). Dengan demikian, PAS bisa linier, siklik; atau jika strukturnya menunjukkan kedua jenis, bercabang.
Tata nama
 Asam fosfat. Sumber: Commons.Wikimedia.org
Asam fosfat. Sumber: Commons.Wikimedia.org Nomenklatur asam fosfat diperintah oleh IUPAC dan bagaimana garam nullion oxoacid dinamai.
Karena di h3PO4 Atom P memiliki Valencia +5, yang memiliki nilai terbesar, asamnya ditugaskan akhiran -ICO ke awalan fosfor-.
Ortho-
Namun, asam fosfat juga biasanya diceritakan asam ortofosfat. Karena? Karena kata 'ortho' adalah bahasa Yunani dan berarti 'benar'; yang akan menghasilkan "bentuk yang benar" atau "lebih terhidrasi" dari hal yang sama.
Saat anhydro fosfat terhidrasi dengan kelebihan air (p4SALAH SATU10, Tutup "Gambar Superior"))3PO4 (3H2Atau · p2SALAH SATU5). Dengan demikian, awalan orto diberikan kepada asam yang dibentuk dengan air yang berlimpah.
Piro-
Awalan PIRO- mengacu pada setiap senyawa yang berasal dari penerapan panas, karena asam diposfor muncul dari dehidrasi termal asam fosfatik. Oleh karena itu disebut asam pirofosfat (2 jam2Atau · p2SALAH SATU5).
Sasaran-
Awalan target, yang juga merupakan kata Yunani, berarti 'setelah'. Ini ditambahkan ke zat -zat yang formulanya telah menghilangkan molekul, dalam hal ini, yaitu air:
H3PO4 => HPO3 + H2SALAH SATU
Perhatikan bahwa kali ini penambahan dua unit fosfat tidak terpikir untuk membentuk asam diposforik, tetapi alih -alih asam metafosfat diperoleh (dari mana tidak ada bukti keberadaannya).
Dapat melayani Anda: etil alkohol: struktur, sifat, penggunaan, mendapatkanPenting juga untuk menyoroti bahwa asam ini dapat digambarkan sebagai h2Atau · p2SALAH SATU5 (Mirip dengan hemidrate, mengalikan HPO3 Untuk 2). Meta awalan sangat sesuai dengan PAS siklik, karena jika asam trphosphoric menjadi dehidrasi, tetapi tidak menambahkan unit lain H3PO4 Untuk menjadi asam tetraphosfat, maka Anda harus membentuk cincin.
Dan ini sama dengan asam polimeetofosfat lainnya, meskipun IUPAC merekomendasikan untuk menyebutnya sebagai senyawa siklik dari PA yang sesuai.
Sifat asam fosfat
Formula molekul
H3PO4
Berat molekul
97.994 g/mol
Penampilan fisik
Dalam bentuk padatnya ia menyajikan kristal ortorombik, higroskopis dan transparan. Dalam bentuk cair itu kristal, dengan penampilan sirup kental.
Secara komersial dicapai dalam larutan air dengan konsentrasi 85% P/P. Dalam semua presentasi ini tidak memiliki bau.
Titik mendidih dan fusi
158º C (316º F A 760 mmHg).
108º F (42.2º C).
Kelarutan air
548 g/100 g H2Atau 20º C; 369,4 g/100 ml pada 0,5º C; 446 g/100m pada 14,95º C.
Kepadatan
1.892 g/cm3 (padat); 1.841 g/cm3 (Solusi 100%); 1.685 g/cm3 (Solusi 85%); 1.334 g/cm3 Solusi 50%) pada 25ºC.
Kepadatan uap
Relatif udara 3.4 (udara = 1).
Pengapian diri
Itu tidak mudah terbakar.
Zat yang lengket dan kental
3.86 MPOISE (40% hingga 20º C).
Keasaman
PH: 1,5 (larutan 0,1 N dalam air)
PKa: pKa1 = 2.148; PKA2 = 7.198 dan PKA3 = 12.319. Oleh karena itu, hidrogennya yang paling asam adalah yang pertama.
Penguraian
Saat dia dipanaskan, dia melepaskan fosfor oksida. Jika suhu naik menjadi 213º C atau lebih, itu menjadi asam pirofosfat (H4P2SALAH SATU7).
Korosivitas
Korosif untuk logam dan aluminium besi. Saat bereaksi dengan logam ini, gas yang mudah terbakar hidrogen berasal.
Polimerisasi
Polimeriza dengan senyawa tipuan, epoksida dan senyawa yang dapat dipolimerisasi.
Penggunaan asam fosfat
Fosfat dan umum menggunakan penjualan
-Asam fosfat berfungsi sebagai dasar untuk elaborasi fosfat, yang digunakan sebagai pupuk karena fosfor adalah nutrisi utama tanaman.
-Ini telah digunakan dalam pengobatan keracunan terkemuka dan kondisi lain di mana jumlah fosfat penting dan produksi asidosis ringan diperlukan.
-Ini digunakan untuk mengontrol pH saluran kemih pada bulu dan kucing untuk menghindari pembentukan perhitungan ginjal.
-Asam fosfat menyebabkan garam Na2HPO4 dan nah2PO4 yang merupakan sistem penyerap kejut pH dengan PKA 6.8. Sistem pengatur pH ini hadir pada manusia, memiliki kepentingan dalam regulasi pH intraseluler, serta dalam pengelolaan konsentrasi hidrogen di tubulus distal dan kolektor nefron.
-Ini digunakan dalam eliminasi lapisan mohosa oksida besi yang menumpuk pada logam ini. Asam fosfat membentuk besi fosfat, yang dapat dengan mudah dihilangkan dari permukaan logam. Ini juga digunakan dalam semir listrik aluminium.
Industrialis
-Asam fosfat ditakdirkan sebagai zat katalitik dalam elaborasi nilon dan bensin. Ini digunakan sebagai agen penurunan dalam ukiran litografi, dalam elaborasi pewarna untuk digunakan dalam industri tekstil, dalam proses koagulasi lateks dalam industri pantai dan dalam pemurnian hidrogen peroksida (hidrogen peroksida (hidrogen peroksida).
-Asam digunakan sebagai aditif dalam minuman ringan yang berkontribusi dalam cara ini untuk rasanya. Diencerkan, diterapkan dalam proses pemurnian gula. Ini juga bertindak sebagai sistem penyerap kejut dalam persiapan ham, gelatin dan antibiotik.
Dapat melayani Anda: aluminium hidroksida: struktur, sifat, penggunaan, risiko-Campur tangan dalam elaborasi deterjen, dalam katalisis asam produksi asetilena.
-Ini digunakan sebagai asidulant dalam makanan seimbang untuk industri ternak dan hewan peliharaan. Industri farmasi menggunakannya dalam pembuatan obat antiemetik. Ini juga memanfaatkan campuran untuk membuat aspal untuk membuka tanah dan memperbaiki retakan.
-Asam fosfat bertindak sebagai katalis dalam reaksi hidrasi alkena untuk menghasilkan alkohol, terutama etanol. Selain itu, digunakan dalam penentuan batubara organik di tanah.
Dental
Itu digunakan oleh dokter gigi untuk membersihkan dan mengkondisikan permukaan gigi sebelum penempatan penyangga gigi. Ini juga menemukan penggunaan dalam pemutihan gigi dan penghapusan pelat gigi. Selain itu, digunakan dalam pembuatan lem untuk prostesis gigi.
Kosmetik
Asam fosfat digunakan untuk menyesuaikan pH dalam elaborasi produk kosmetik dan untuk perawatan kulit. Ini digunakan sebagai agen pengoksidasi kimia untuk produksi karbon aktif.
Pembentukan asam fosfat
-Asam fosfat dibuat dari batuan fosfat tipe apatit, dengan cara pencernaan asam sulfat terkonsentrasi:
Ac3(PO4)2 + 3 h2Sw4 + 6 h2O => 2 jam3PO4 + 3 (case4.2h2SALAH SATU)
Asam fosfat yang diperoleh dalam reaksi ini adalah kemurnian rendah, sehingga mengalami proses pemurnian yang mencakup presipitasi, ekstraksi pelarut, kristalisasi dan teknik pertukaran ion.
-Asam fosfat dapat terjadi dengan melarutkan fosfor pentoksida dalam air mendidih.
-Ini juga dapat diperoleh dengan memanaskan fosfor dengan campuran uap udara dan air:
P4 (l) +5 o2 (g) => p4SALAH SATU10 (S)
P4SALAH SATU10 (s) +h2Atau (g) => 4h3PO4 (L)
Risiko
-Karena tekanan uap Anda rendah pada suhu kamar, tidak mungkin uap Anda dapat dihirup, kecuali asam disemprotkan. Jika demikian, gejala inhalasi mereka meliputi: batuk, sakit tenggorokan, pernapasan pendek dan melelahkan.
-Dalam literatur kasus pelaut yang terpapar uap asam fosfat untuk jangka waktu yang lama dikutip. Menderita kelemahan umum, batuk kering, nyeri dada dan masalah pernapasan. Setelah satu tahun setelah pameran, disfungsi reaktif dari saluran pernapasan diamati.
-Kontak kulit dengan asam fosfat dapat menyebabkan kemerahan, nyeri, lepuh dan luka bakar kulit.
-Kontak asam dengan mata, tergantung pada konsentrasinya dan durasi kontak, dapat dihasilkan di dalamnya, lesi korosif jaringan atau luka bakar parah dengan kerusakan okular permanen.
-Konsumsi asam menyebabkan luka bakar di mulut dan tenggorokan, sensasi semangat di luar sternum, nyeri perut, muntah, syok dan runtuh.
Referensi
- Royal Society of Chemistry. (2015). Asam fosfat. Diambil dari: chemspider.com
- Pusat Keselamatan Kesehatan dan Kerja Kanada. (1999). Efek Asam Fosfat - Efek Kesehatan. Diambil dari: ccsso.Ac
- Asam.Info. (2018). Asam fosfat "Variasi penggunaan senyawa kimia ini. Diambil dari: asam.Info
- James p. Smith, Walter E. Brown, dan James R. Lehr. (1955). Struktur asam fosfat kristal. J. SAYA. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Asam fosfat dan fosfat. Diambil dari: di.Wikipedia.org
- Sains itu menyenangkan. Pelajari tentang asam fosfat. [PDF]. Diambil dari: scifun.Chem.Wisc.Edu

