Struktur asam humat, sifat, memperoleh, menggunakan

- 959
- 165
- Frederick Pfeffer
Asam Humat Itu adalah nama generik dari keluarga senyawa organik yang merupakan bagian dari zat humat. Mereka memiliki berbagai kelompok fungsional, di antaranya turunan karboksilat, fenolik, gula, quinonas dan asam amino dapat disebutkan.
Zat humat, di mana asam humat adalah bagian, didistribusikan di tanah, perairan alami dan sedimen, karena merupakan hasil dari dekomposisi tumbuhan, hewan, dan limbah alami.
 Bahan organik yang akan menjadi zat seperti asam humat. Penulis: Pisauikan. Sumber: Pixabay.
Bahan organik yang akan menjadi zat seperti asam humat. Penulis: Pisauikan. Sumber: Pixabay. Asam basah adalah bagian dari humus dan memiliki kemampuan untuk meningkatkan pertumbuhan tanaman dan nutrisi mereka, karena mereka memungkinkan penahan nutrisi lebih lama di tanah sehingga tersedia untuk tanaman.
Mereka adalah senyawa amphiphyllic, yaitu, mereka memiliki bagian yang terkait dengan air dan bagian yang menolak air, semuanya dalam molekul yang sama.
Untuk grup mereka -oh dan -cooh mereka dapat membentuk kompleks dengan ion logam atau kation.
Berkat rantai hidrokarbon atau bagian aromatik mereka dapat melarutkan dan melampirkan molekul aromatik poliklik yang beracun. Selain itu, mereka memiliki potensi penggunaan dalam pengobatan kanker dan dalam persiapan produk farmasi yang lebih efektif.
[TOC]
Struktur
Asam basah mengandung kelompok fungsional yang berbeda yang jumlahnya tergantung pada asal geografis asam humat, usia, kondisi lingkungan dan biologis dan iklim di mana molekul terjadi. Karena alasan ini, karakterisasi yang tepat menjadi sulit.
Kelompok fungsional utamanya adalah fenolik, karboksilat, enolik, kuinon, eter, gula dan peptida.
Kelompok fungsional yang memberikan karakteristik utama mereka adalah kelompok fenolik, karboksilat dan quinonas.
Struktur besar asam humat terdiri dari bagian hidrofilik yang dibentuk oleh kelompok -OH dan bagian hidrofobik yang dibentuk oleh rantai alifatik dan cincin aromatik.
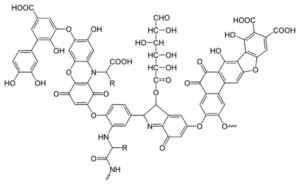 Contoh molekul asam humat, di mana Anda dapat melihat kelompok -oh fenolik, -kohoh, kuinon, sisa -sisa gula dan peptida (-NH). Yikrazuul [domain publik]. Sumber: Wikimedia Commons.
Contoh molekul asam humat, di mana Anda dapat melihat kelompok -oh fenolik, -kohoh, kuinon, sisa -sisa gula dan peptida (-NH). Yikrazuul [domain publik]. Sumber: Wikimedia Commons. Tata nama
- Asam humat.
- Ha atau punya (akronim untuk bahasa Inggris Asam humat).
Properti
Keadaan fisik
Padatan amorf.
Berat molekul
Berat molekulnya berkisar dari 2,0 hingga 1300 kDa.
A DA atau Dalton bernilai 1,66 x 10-24 gram.
Kelarutan
Asam basah adalah fraksi zat humat yang larut dalam medium berair basa. Mereka sebagian larut dalam air. Tidak larut dalam media asam.
Pembubaran airnya kompleks karena asam humat bukanlah komponen individual tetapi campuran komponen, di mana hanya beberapa dari mereka yang larut dalam air.
Kelarutannya dapat bervariasi tergantung pada komposisinya, pH dan gaya ionik pelarut.
Sifat kimia dan biologis
Molekul asam humat umumnya memiliki bagian hidrofilik, atau terkait dengan air, dan bagian hidrofobik, yang menolak air. Oleh karena itu dikatakan bahwa mereka amfifilik.
Dapat melayani Anda: putrescina: struktur, sifat, sintesis, penggunaanKarena karakter amphiphyllicnya, asam humic terbentuk, dalam lingkungan netral atau asam, struktur yang mirip dengan misel, yang disebut semu-pseudo-mys.
Mereka adalah asam lemah, yang disebabkan oleh gugus fenolik dan karboksilat.
Kelompok tipe Quinona bertanggung jawab untuk pembentukan spesies oksigen reaktif, karena mereka direduksi menjadi semi -setengah dan kemudian menjadi hidrokuinon yang sangat stabil.
Kehadiran gugus fenolik dan karboksilat dalam molekul asam humat memberi mereka kemampuan untuk meningkatkan pertumbuhan tanaman dan nutrisi mereka. Kelompok semacam itu juga dapat mendukung pembentukan kompleks dengan logam berat. Dan mereka juga menjelaskan aktivitas antivirus dan anti -inflamasi mereka.
Di sisi lain, kehadiran quinone, fenol dan kelompok karboksilat terkait dengan antioksidan, fungisida, bakterisida dan antimingogensi atau kemampuan demutagenik mereka.
Perilaku dalam media berair menurut pH
Dalam medium alkali, kelompok karboksilat dan fenolik menderita hilangnya proton H+, Apa yang ditinggalkan molekul secara negatif di masing -masing kelompok tersebut.
Karena itu, penolakan muatan negatif terjadi dan molekul membentang.
Dengan mengurangi pH, gugus fenolik dan karboksilat diprotonasi lagi dan efek tolakan berhenti, menyebabkan molekul mengadopsi struktur yang ringkas, mirip dengan mikle.
Dalam hal ini, bagian hidrofobik adalah tentang menempatkan di dalam molekul dan bagian hidrofilik bersentuhan dengan lingkungan berair. Dikatakan bahwa struktur ini adalah pseudo-mys.
Perilaku ini menegaskan bahwa asam humat memiliki karakteristik tekad.
Selain itu, mereka membentuk agregat intramolekul (dalam molekul mereka sendiri), diikuti oleh agregasi antarmolekul (antara molekul yang berbeda) dan presipitasi.
Pelarut molekul non-polar besar
Asam basah dapat melarutkan hidrokarbon aromatik polycyclic yang beracun dan karsinogenik dan relatif tidak larut dalam air.
Hidrokarbon ini dilarutkan di jantung hidrofobik pseudo-psikel asam humat.
Pelatihan kompleks dengan kation logam
Asam basah berinteraksi dengan ion logam dalam media alkali di mana kation positif atau ion bertindak dengan menetralkan beban negatif dari molekul asam humat.
Semakin besar beban kation, semakin besar efektivitasnya membentuk pseudo-micelas. Kation terletak di tempat yang lebih disukai secara termodinamik dalam struktur.
Proses ini menghasilkan kompleks asam humat-logam yang memperoleh bentuk bola.
Interaksi ini tergantung pada logam dan asal, berat molekul dan konsentrasi asam lembab.
Memperoleh
Asam basah dapat diperoleh dari bahan organik tanah. Namun, struktur berbagai molekul asam humat bervariasi sesuai dengan lokasi tanah, usia dan kondisi iklimnya.
Ada berbagai metode untuk mendapatkan. Di bawah ini.
Ini adalah tanah dengan larutan berair NaOH 0,5 N (setara 0,5 per liter) di bawah atmosfer nitrogen selama 24 jam pada suhu kamar. Set disaring.
Itu dapat melayani Anda: Apa hukum kimia berat? (Contoh)Ekstrak alkali diasamkan dengan HCl 2 N hingga pH 2 dan diamkan selama 24 jam, pada suhu kamar. Bahan koagulasi (asam humat) dipisahkan dari supernatan dengan sentrifugasi.
Aplikasi
- Di bidang pertanian
Penggunaan asam humat dalam pertanian praktis dikenal sejak awal aktivitas pertanian karena mereka adalah bagian dari humus.
 Bumi kaya akan humus, karena itu kaya akan asam humat, baik untuk budidaya tanaman. Penulis: Markus Baumeler. Sumber: Pixabay.
Bumi kaya akan humus, karena itu kaya akan asam humat, baik untuk budidaya tanaman. Penulis: Markus Baumeler. Sumber: Pixabay. Asam humat meningkatkan pertumbuhan dan nutrisi tanaman. Mereka juga bertindak sebagai bakterisida tanah dan fungisida yang melindungi tanaman. Asam basah menghambat jamur fitopatogenik dan beberapa kelompok fungsionalnya dengan aktivitas ini telah berkorelasi.
 Tanaman terinfeksi alternaria solani jamur yang dapat diperjuangkan dengan asam humat. Afrozilian [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Tanaman terinfeksi alternaria solani jamur yang dapat diperjuangkan dengan asam humat. Afrozilian [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Kehadiran kelompok belerang dan karbonil C = O dalam molekul asam humat mendukung aktivitas fungistatik. Sebaliknya, kandungan oksigen yang tinggi, gugus C-O aromatik dan atom karbon tertentu milik gula menghambat gaya fungistatik asam humat.
Baru -baru ini (2019), efek dari penerapan pupuk nitrogen pelepasan lambat telah dipelajari dalam stabilisasi asam humat yang ada di tanah dan pengaruhnya terhadap tanaman.
Ditemukan bahwa urea yang ditutupi dengan biokarbon meningkatkan struktur dan stabilitas asam humat yang ada di tanah, mendukung retensi nitrogen dan karbon oleh tanah dan meningkatkan hasil tanaman.
- Dalam remediasi polusi
Karena kemampuannya untuk membentuk medis semu dalam netral atau asam.
Logam adalah beberapa polutan yang dapat dihilangkan dengan asam humat.
Beberapa penelitian menunjukkan bahwa efisiensi penyerapan logam oleh asam humat dalam larutan berair cenderung meningkat ketika pH dan konsentrasi asam humat dan dengan mengurangi konsentrasi logam.
Juga ditentukan bahwa ion logam bersaing untuk situs aktif molekul asam humic, yang umumnya merupakan kelompok fenolik -COOH dan -OH dalam hal ini.
- Di industri farmasi
Kegunaannya telah diuji untuk meningkatkan kelarutan air obat hidrofobik.
Nanopartikel perak (AG) disiapkan ditutupi dengan asam humat, yang berhasil tetap stabil selama setidaknya satu tahun.
Nanopartikel perak dan asam humat ini, bersama dengan sifat antibakteri yang terakhir, memiliki potensi tinggi untuk persiapan obat.
Demikian juga, kompleks karbamazepin telah diuji, obat antiepilepsi, dengan asam humat untuk meningkatkan kelarutannya, dan ternyata obat menjadi jauh lebih larut dan efektif.
Dapat melayani Anda: rodio: sejarah, sifat, struktur, penggunaan, risikoEfek peningkatan kelarutan dan bioavailabilitas yang sama dicapai dengan asam humic dan kompleks β-karoten, prekursor vitamin A.
- Dalam kedokteran
Asam basah adalah sekutu yang kuat dalam pengobatan beberapa penyakit.
Terhadap beberapa virus
Aktivitas antivirus asam humic terhadap sitomegalovirus dan virus imunodefisiensi manusia HIV-1 dan HIV-2, antara lain.
Molekul asam humat dapat menghambat replikasi virus dengan bergabung dengan beban negatifnya dalam medium alkali dengan tempat kationik tertentu dari virus, yang diperlukan untuk virus untuk bergabung dengan permukaan sel sel.
Melawan kanker
Asam basah telah ditemukan mengerahkan sifat penyembuhan lesi karsinogenik. Ini disebabkan oleh keberadaan kuinon dalam strukturnya.
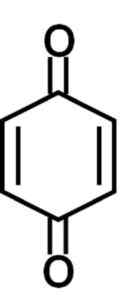 Struktur kuinon, kelompok yang ada dalam molekul beberapa asam humat. Penulis: Marilú Stea.
Struktur kuinon, kelompok yang ada dalam molekul beberapa asam humat. Penulis: Marilú Stea. Kuinon menghasilkan spesies oksigen reaktif yang menghasilkan stres oksidatif dan menginduksi apoptosis sel kanker melalui fragmentasi DNA mereka.
Melawan mutagenesis
Asam basah adalah inhibitor mutagenesis di dalam sel dan di luar ini. Mutagenesis adalah perubahan stabil dari bahan genetik sel yang dapat ditularkan ke sel anak.
Telah ditemukan bahwa kemampuan untuk menghambat mutagenesis bervariasi dengan komposisi asam humat dan konsentrasi mereka.
Di sisi lain, mereka memberikan efek demutagenik pada zat mutagenik seperti benzopyrene (hidrokarbon poletomatomatik hadir dalam beberapa makanan), 2-nitrofluoreno (produk hidrokarbon polianaromatik dari pembakaran) dan 2-aminoantraceneo.
 Efek mutagenik benzopyrene dalam DNA. Oleh Richard Wheeler (Zephyris) 2007. Solusi Strupture dari adduct trans-op-op (10s) -DA dari +)-(7s, 8r, 9s, 10r) -7,8-dihydroxy-9,10-epoxy-7,8,10-tetrahydrobenzo [a] pyrene dalam dupleks DNA. Diproduksi dari PDB | 1JDG. == lisensi == gfdl-. Sumber: Wikimedia Commons.
Efek mutagenik benzopyrene dalam DNA. Oleh Richard Wheeler (Zephyris) 2007. Solusi Strupture dari adduct trans-op-op (10s) -DA dari +)-(7s, 8r, 9s, 10r) -7,8-dihydroxy-9,10-epoxy-7,8,10-tetrahydrobenzo [a] pyrene dalam dupleks DNA. Diproduksi dari PDB | 1JDG. == lisensi == gfdl-. Sumber: Wikimedia Commons. Mekanisme efek ini terletak pada adsorpsi mutagen, sehingga asam humat dengan struktur yang lebih besar adalah yang paling efektif. Mutagen diadsorpsi oleh asam humat dan kehilangan aktivitas mutageniknya.
Diperkirakan bahwa ini bisa penting untuk perlindungan terhadap karsinogenesis.
- Di industri kosmetik
Karena kemampuan mereka untuk menyerap sinar UV dan yang terlihat, asam humic telah diusulkan untuk digunakan dalam blocker surya, krim anti -laling dan produk perawatan kulit.
Mereka juga dapat digunakan sebagai pengawet produk kosmetik.
- Di industri makanan
Untuk sifat antioksidannya, penggunaannya telah disarankan sebagai pengawet makanan dan sebagai suplemen nutrisi.
Referensi
- Gomes de Melo, b.KE. et al. (2016). Asam humat: Sifat struktural dan beberapa fungsional untuk perkembangan teknologi baru. Ilmu dan Teknik Bahan C 62 (2016) 967-974. Pulih dari scientedirect.com.
- Kita adalah. et al. (2018). Aktivitas Fungistatik Asam Humat Multiorigin Sehubungan Dengan Struktur Kimianya. Jurnal Pertanian dan Kimia Pangan 2018, 66, 28, 7514-7521. Pulih dari pub.ACS.org.
- Kerndorff, h. dan Schnitzer, m. (1980). Penyerapan logam pada asam humat. Geochimica et Cosmochimica Acta Vol 44, pp.1701-1708. Pulih dari scientedirect.com.
- Sato, t. et al. (1987). Mekanisme efek demutagenik asam humat. Penelitian Mutasi, 176 (1987) 199-204. Pulih dari scientedirect.com.
- Cheng, m.-L. et al. (2003). Asam humat menginduksi kerusakan DNA oksidatif, retardasi pertumbuhan, dan apoptosis pada fibroblas primer manusia. EXP Biol Med (Maywood) 2003 AP; 228 (4): 413-23. NCBI pulih.Nlm.Nih.Pemerintah.
- Li, m. et al. (2019). Sekuestrasi karbon organik dalam substansi humat tanah. Jurnal Pertanian dan Kimia Pangan, 2019, 67, 11, 3106-3113. Pulih dari pub.ACS.org.

