Asam selenhydric (H2SE) Apa itu, struktur, sifat, penggunaan
- 4345
- 1253
- Pete Lesch
 Hidrogen seleniuro: dua molekul hidrogen dan satu selenium
Hidrogen seleniuro: dua molekul hidrogen dan satu selenium Apa itu asam selenhydric?
Dia Asam selenhydric o hidrogen seleniuro adalah senyawa anorganik yang formula kimianya h2DIA. Ini bersifat kovalen, dan dalam kondisi suhu dan tekanan biasa itu adalah gas yang tidak berwarna; Tetapi dengan aroma yang kuat dari kehadirannya yang kecil. Secara kimiawi, ini adalah pelacakan, jadi selenium memiliki valencia -2 (i2-).
Dari semua seleniuros, h2Ini adalah yang paling beracun karena molekulnya kecil dan atom seleniumnya memiliki lebih sedikit hambatan sterik saat bereaksi. Di sisi lain, baunya memungkinkan mereka yang bekerja dengannya untuk mendeteksinya dalam tindakan jika terjadi di luar lonceng laboratorium.
Hidrogen seleniuro dapat disintesis dengan kombinasi langsung dari dua elemennya: hidrogen molekul, h2, dan selenium logam. Ini juga dapat diperoleh dengan melarutkan senyawa yang kaya akan selenium, seperti besi seleniuro (II), fese, dalam asam klorida.
Di sisi lain, asam selenhydric dibuat dengan melarutkan hidrogen seleniuro dalam air; Yaitu, yang pertama dilarutkan di dalam air, sedangkan yang kedua terdiri dari minuman ringan.
Penggunaan utamanya adalah menjadi sumber selenium dalam sintesis organik dan anorganik.
Struktur hidrogen seleniuro
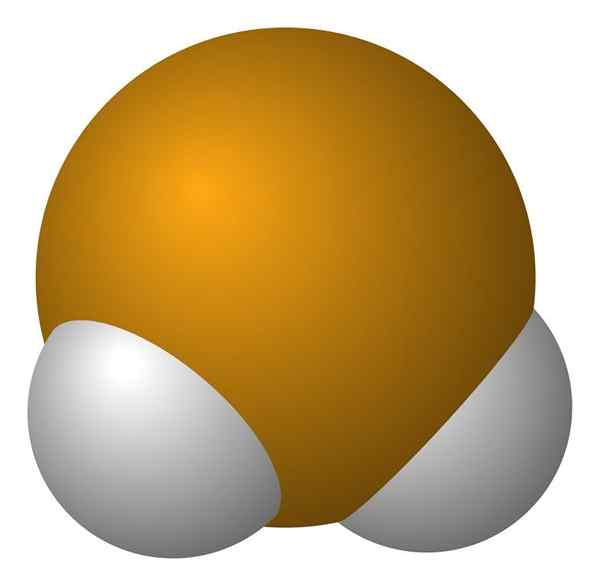
 Molekul hidrogen seleniuro. Wikimedia Commons.
Molekul hidrogen seleniuro. Wikimedia Commons. Molekula h2Ini adalah geometri sudut, meskipun sudutnya 91 ° membuatnya terlihat lebih seperti L daripada ke v. Dalam model bola dan batang ini, atom hidrogen dan selenium adalah bola putih dan kuning, masing -masing.
Molekul ini, seperti yang ditunjukkan, adalah yang ada dalam fase gas; yaitu, untuk hidrogen seleniuro. Saat larut dalam air, ia melepaskan proton dan dalam larutan Anda memiliki pasangan HSE- H3SALAH SATU+; Torsi ion ini datang ke asam selenhydric, dilambangkan sebagai h2SE (AC) untuk membedakannya dari hidrogen seleniuro, h2SE (g).
Dapat melayani Anda: Methylene Blue: Karakteristik, Persiapan, Penggunaan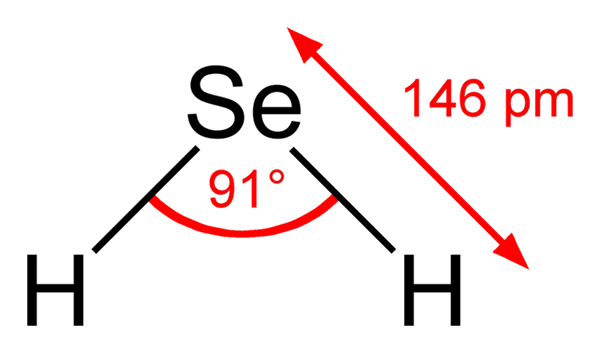 Formula Struktural Asam Seleenhydric. Ben Mills, Wikimedia Commons ..
Formula Struktural Asam Seleenhydric. Ben Mills, Wikimedia Commons .. Oleh karena itu, struktur antara h2SE (AC) dan H2SE (g) sangat berbeda; Yang pertama dikelilingi oleh bola berair dan memiliki beban ionik, dan yang kedua terdiri dari aglomerat molekul fase gas.
Molekul H2Mereka hampir tidak dapat berinteraksi satu sama lain melalui kekuatan yang sangat lemah dipolo-dipolo. Selenium, meskipun kurang elektronegatif daripada sulfur memusatkan kepadatan elektronik yang lebih besar untuk "merebutnya" dari atom hidrogen.
Selenio Hydrues terkompresi
Jika m molekul2Mereka mengalami tekanan luar biasa (ratusan IPK), secara teoritis mereka dipaksa untuk memperkuat dengan membentuk tautan SE-H-SE; Ini adalah tautan dari tiga pusat dan dua elektron (3C-2E) di mana hidrogen berpartisipasi. Oleh karena itu, molekul mulai membentuk struktur polimer yang mendefinisikan padatan.
Dalam kondisi ini, padatan dengan lebih banyak hidrogen dapat diperkaya, yang sepenuhnya memodifikasi struktur yang dihasilkan. Selain itu, komposisi menjadi tipe HNSE, di mana n bervariasi dari 3 hingga 6. Dengan demikian, selenium hidrida dikompres oleh tekanan -tekanan ini, dan di hadapan hidrogen, memiliki formula kimia h3Saya tahu h6DIA.
Diperkirakan bahwa hidror selenium yang diperkaya dengan hidrogen ini memiliki sifat superkonduktif.
Properti
Penampilan fisik
Gas tidak berwarna yang pada suhu rendah berbau seperti putrefacto dan telur busuk jika konsentrasinya meningkat. Bau lebih buruk dan lebih intens daripada hidrogen sulfida (yang sudah sangat tidak menyenangkan). Namun, ini bagus, karena membantu deteksi yang mudah dan mengurangi risiko kontak atau inhalasi yang berkepanjangan.
Saat terbakar, ia mengeluarkan produk api kebiruan dari interaksi elektronik dalam atom selenium.
Dapat melayani Anda: sulfur oksidaMassa molekul
80,98 g/mol.
Titik didih
-41 ° C.
Titik lebur
-66 ° C.
Tekanan uap
9,5 atm pada 21 ° C.
Kepadatan
3.553 g/l.
Pkke
3.89.
Kelarutan air
0,70 g/100 ml. Ini menguatkan fakta bahwa atom selenium dari h2Anda tidak dapat membentuk jembatan hidrogen yang cukup dengan molekul air.
Kelarutan dalam pelarut lain
-Larut dalam cs2, yang tidak mengherankan dengan analogi kimia antara selenium dan sulfur.
-Phosgen larut (pada suhu rendah, karena mendidih pada 8 ° C).
Tata nama
Seperti dijelaskan pada bagian sebelumnya, nama senyawa ini bervariasi tergantung pada apakah h2Itu dalam soda atau fase terlarut dalam air. Saat berada di dalam air, ada pembicaraan tentang asam seleenhydric, yang tidak lebih dari hidrasi dalam istilah anorganik. Tidak seperti molekul gas, karakter asamnya lebih besar.
Namun, baik sebagai gas atau dilarutkan dalam air, atom selenium mempertahankan karakteristik elektronik yang sama; Misalnya, valencia -nya adalah -2, kecuali jika Anda menderita reaksi oksidasi. Valencia -2 ini adalah alasan mengapa itu disebut seleniAurochs hidrogen, karena anion seleniuro adalah2-; yang lebih reaktif dan reduser daripada S2-, sulfida.
Jika nomenklatur sistematis digunakan, jumlah atom hidrogen dalam senyawa harus ditentukan. Jadi, h2Itu disebut: seleniuro dari telah memberihidrogen.
Seleniuro atau hidrida?
Beberapa sumber menyebutnya sebagai hidrida. Jika memang benar, selenium akan memiliki muatan positif +2, dan beban negatif hidrogen -1: SEH2 (DIA2+, H-). Selenium adalah atom yang lebih elektronegatif daripada hidrogen, dan karenanya berakhir "memonopoli" kepadatan elektronik tertinggi dalam molekul H2DIA.
Dapat melayani Anda: termokimiaNamun, dengan demikian, keberadaan selenium hidrida tidak dapat dibuang. Faktanya, dengan adanya anion H- Ini akan memfasilitasi tautan SE-H-SE, yang bertanggung jawab atas struktur padat yang dibentuk untuk tekanan besar menurut studi komputer.
Aplikasi
Metabolisme
Meskipun tampaknya bertentangan, meskipun toksisitas besar H2SE, diproduksi di dalam tubuh pada rute metabolisme selenium. Namun, sel -sel hampir tidak diproduksi sebagai perantara dalam sintum selenioprotein, atau akhirnya dimetilasi dan diekskresikan; Salah satu gejala ini adalah rasa bawang putih di mulut.
Industrialis
H2Ini terutama digunakan untuk menambahkan atom selenium ke struktur padat, seperti bahan semikonduktor; ke molekul organik, seperti alkena dan nitril untuk sintesis seleniuros organik; atau solusi untuk mengendapkan seleniuros logam.
Referensi
- Hidrogen selenide. Diperoleh dari: di.Wikipedia.org
- Hidrogen selenide, h2DIA. Pulih dari: selenium.Atomistri.com

