Struktur asam sulfámic, sifat, sintesis, penggunaan
- 904
- 56
- Irvin Reichel
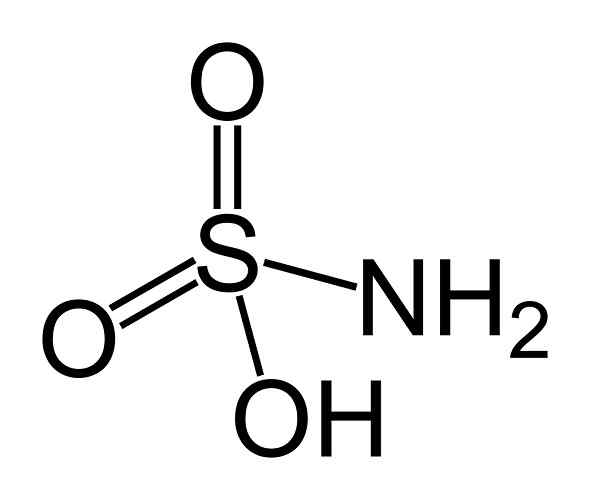
Dia asam sulfamik Ini adalah senyawa anorganik yang dibentuk oleh atom sulfur (S) yang terpasang dalam bentuk kovalen dan oleh tautan sederhana ke gugus hidroksil (-OH) dan gugus amino (-NH2), dan dengan ikatan rangkap ke dua atom oksigen (O). Itu adalah padatan kristal putih. Formula kimianya adalah NH2Sw3H. Ini juga dikenal sebagai asam aminosulfonat, asam amidosulfonat, asam amidosulfurat dan asam sulfamidat.
Asam sulfámic adalah asam yang kuat. Anda dapat bereaksi dengan logam, logam dan oksida karbonat. Garamnya umumnya larut dalam air, jadi ini merupakan penghilang yang baik dari inlay dalam peralatan proses. Ini sering digunakan dalam pabrik gula untuk membersihkan inlay karbonat di evaporator.
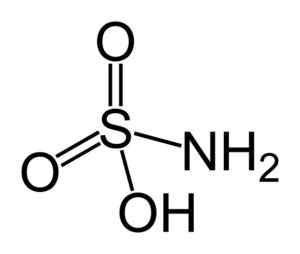 Struktur asam sulfámic. Benjah-BMM27 [Domain Publik]. Sumber: Wikipedia Commons.
Struktur asam sulfámic. Benjah-BMM27 [Domain Publik]. Sumber: Wikipedia Commons. Asam sulfámic adalah peredam nitrit (tidak2-) dan sifat kimia ini digunakan dalam beberapa aplikasi, seperti dalam industri pewarna dan analisis nitrit.
Ini telah digunakan dalam penyamakan kulit dan pemutihan pulp untuk pembuatan kertas. Faktanya, ini adalah kontaminan makanan, seperti yang sering ditemukan di kertas dan kartu yang digunakan untuk mengemas toko kelontong.
Ini juga digunakan dalam elektroda logam, sebagai pola laboratorium dan salah satu turunannya adalah herbisida yang sangat efektif.
[TOC]
Struktur
Asam sulfamat mengkristal dalam bentuk kristal ortorombus bipiramidal. Bentuk prisma dan lembaran yang kompak saat mengkristal dari larutan dingin, serta lembaran belah ketupat saat membuatnya menjadi larutan air panas.
Tata nama
- Asam sulfamik
- Asam aminosulfonat
- Asam amidosulfonat
- Asam amidosulfuri
- Sulfami -acid
Properti
Keadaan fisik
Solid kristal putih.
Berat molekul
97.1 g/mol.
Titik lebur
205 ºC, terurai pada 209 ºC.
Kepadatan
2.15 g/cm3
Kelarutan
Larut dalam air:
- 12,8% hingga 0 ºC
- 17,57% pada 20 ºC
- 22,77% pada 40 ° C
Hampir tidak larut dalam metanol, sedikit larut dalam aseton, tidak larut dalam eter.
Larut bebas dalam basa nitrogen dan pelarut organik yang mengandung nitrogen.
Tidak larut dalam karbon disulfida (CS2) dan karbon tetraklorida (CCL4).
ph
0,41 (dalam solusi 1 N, yaitu, 1 setara/l).
Konstan disosiasi
0.101 hingga 25 ºC.
Sifat kimia
Itu adalah asam yang kuat. Hampir sebanyak asam klorida (HCl), nitrat3) dan sulfat (h2Sw4).
Dapat melayani Anda: senyawa teroksigenasi: sifat, reaksi, penggunaanLarutan asam sulfamat berair sangat terionisasi. PH lebih rendah dari larutan asam format, fosfat dan oksalat.
Dalam air, asam sulfamat hanya kehilangan proton yang terikat pada oksigen. Nitrogen -Droin Hydrogen tetap bersatu dengan kuat.
Dalam larutan berair perlahan dihidrolisis untuk memberikan amonium asam sulfat (NH4Hso4). Stabil dalam kondisi kering.
Serangan asam sulfámic logam, oksida logam dan karbonat untuk menghasilkan sulfamat. Misalnya, dengan kalium logam (k) kalium sulfamat (koso2NH2) dan hidrogen (h2).
Semua garam asam sulfamat larut dalam air. Garam kalsium, timbal dan barium sangat larut dalam air, tidak seperti asam sulfat yang sesuai.
Asam nitrat (hno2) Bereaksi secara kuantitatif dengan gugus amino asam sulfamat, melepaskan nitrogen (n2). Diperkirakan bahwa ion sulfamat bekerja dalam reaksi ini sebagai amida, bukan sebagai amina.
Asam sulfámic dioksidasi oleh klorin, bromin atau kalium klorat untuk mengubahnya menjadi asam sulfat. Reaksi ini tidak terjadi dengan oksidan lain seperti asam kromik atau kalium permanganat.
Tidak kompatibel (bereaksi) dengan alkali yang kuat, klorin, asam hipoklor, hipoklorit, sianida dan sulfida.
Properti lainnya
Itu bukan higroskopis (ini berarti tidak menyerap kelembaban udara).
Saat dipanaskan sampai dekomposisi memancarkan asap yang sangat beracun dari sulfur oksida dan hidrogen klorida (HCl).
Salah satu turunannya, amonium sulfamate, adalah retarder api.
Itu cukup beracun.
Perpaduan
Asam sulfámic diperoleh dengan reaksi CO urea (NH2)2 Dengan asam merokok sulfat, yaitu, asam sulfat (h2Sw4) konsentrat yang mengandung sulfur trioksida (jadi3).
Ini juga dapat disintesis dengan bereaksi asam klorosulfonat (HCLO3Cl) dan amonia (NH3).
Aplikasi
Di industri mewarnai
Asam sulfámic digunakan untuk menghilangkan kelebihan nitrit dengan cepat dan efektif dalam reaksi diazotisasi dalam sintesis pewarnaan. Ini jauh lebih praktis daripada urea untuk tujuan ini.
Dalam pemrosesan kulit
Selama penyamakan kulit, penggunaan asam sulfat, bukan asam sulfat memberikan tekstur yang lebih tipis dan lebih halus.
Dapat melayani Anda: mineral logamSelain itu, karena kalsium sulfamat larut dalam air, tidak seperti kalsium sulfat, asam sulfámic dapat digunakan dalam proses yang tidak disengaja tanpa meninggalkan bintik -bintik yang kadang -kadang terjadi pada kulit saat digunakan asam sulfat.
 Alas kaki kulit. Sumber: Pixabay.
Alas kaki kulit. Sumber: Pixabay. Dalam Peralatan Proses Pembersihan
Asam sulfámic digunakan sebagai pembersih decalcifier di bisul, reaktor, pipa, sistem pendingin dan penukar panas.
Dalam peralatan ini, inlays untuk sirkulasi air atau senyawa proses di pabrik energi, pembangkit kimia, pendekatan, pabrik kertas, stasiun kompresi dan industri lainnya terbentuk.
Inlay atau endapan padat dapat berupa organik (ganggang, lumpur, jamur) atau anorganik (besi oksida, besi sulfida, kalsium atau magnesium karbonat, sulfat, fosfat atau silikat).
Asam sulfámic sangat efektif ketika digunakan untuk menghilangkan inlay kalsium karbonat. Ini dapat digunakan dalam peralatan tembaga, kuningan, baja tahan karat, besi cor dan baja galvanis.
Ini digunakan dalam larutan 5-10% berdasarkan berat. Ini digunakan terutama di pabrik gula untuk membersihkan evaporator yang terbuat dari besi cor dengan penukar panas tembaga.
 Tim evaporator di pabrik gula. Penulis: Antiksh Kumar. Sumber: Pixabay
Tim evaporator di pabrik gula. Penulis: Antiksh Kumar. Sumber: Pixabay Itu harus digunakan pada suhu tidak lebih besar dari 50-60 ºC. Suhu 70 ºC menyebabkan pembentukan sulfat yang tidak larut seperti kasus ini4.
Saat digunakan dikombinasikan dengan natrium klorida, efek sinergi terjadi dan larutan memungkinkan oksida besi secara perlahan larut. Dalam hal ini tidak boleh digunakan dengan stainless steel karena asam klorida dilepaskan, yang dapat menyebabkan korosi pada bahan itu.
Dalam pemurnian logam
Elektrodeposisi logam seperti tembaga, perak, kobalt, nikel, seng, kadmium, besi dan timbal dapat berhasil dilakukan dalam larutan asam sulfamat. Ini bisa ditangani lebih mudah daripada asam asam terhidof (h2Sif6).
Sebagai reagen pola di laboratorium
Mengingat karakteristik tertentu dari asam sulfat seperti: kekuatannya sebagai asam, kemudahannya untuk dimurnikan dengan rekristalisasi dalam air, stabilitasnya dan non-hidroskopisitasnya, telah digunakan sebagai standar utama di tingkat laboratorium. Ini berarti bahwa ini digunakan untuk penentuan alkali kuantitatif.
 Laboratorium. Publicdomainpictures. Sumber: Pixabay
Laboratorium. Publicdomainpictures. Sumber: Pixabay Dalam analisis nitrit
Karena reaksinya yang mudah dengan nitrit, asam sulfámic digunakan untuk penentuan ini dalam larutan.
Dapat melayani Anda: asam trikloroasetat: struktur, sifat, sintesis, penggunaan, efekDalam analisis air dibubarkan dalam air
Karena asam sulfamat yang bereaksi dengan nitrit air dilepaskan nitrogen, dimungkinkan untuk menentukan oksigen yang dilarutkan dalam air, karena gangguan yang disebabkan oleh nitrit dihilangkan.
Dalam persiapan nitro oksida
Asam sulfámic bereaksi dengan asam nitrat menghasilkan nitro oksida (N2SALAH SATU). Reaksi ini lebih aman daripada amonium nitrat untuk mendapatkan gas tersebut.
Di bidang pertanian
Turunan asam sulfámic, amonium sulfamat, adalah herbisida non -oktoks untuk hewan.
Ini diterapkan oleh embun di lembaran spesies yang akan dihilangkan pada akhir musim panas atau awal musim gugur, lebih disukai dalam cuaca lembab. Setelah memindahkan senyawa dari daun ke akar, tanaman mati.
 Aplikasi Herbisida Rocío. Penulis: Zefe Wu. Sumber: Pixabay
Aplikasi Herbisida Rocío. Penulis: Zefe Wu. Sumber: Pixabay Keuntungan lain dari senyawa ini adalah bahwa tanah tidak secara permanen mensterilkan. Memang, beberapa nitrogen amonium sulfamat akan tersedia di tanah untuk pertumbuhan tanaman di musim berikutnya.
Dalam kain fireproof
Kompatibilitasnya dengan selulosa dan karakteristik retarder api mengubah amonium sulfamat menjadi agen untuk mendapatkan kain dan kertas yang tahan api.
10% dari berat kain digunakan, yang penampilan dan sensasi sentuhnya tetap tidak berubah. Kain saat digunakan harus dicuci kering, tidak pernah dicuci dengan air agar tidak larut ke sulfamat.
Ini berguna terutama di bioskop atau tempat serupa.
 Teater. Penulis: Mustangjoe Sumber: Pixabay
Teater. Penulis: Mustangjoe Sumber: Pixabay Dalam berbagai aplikasi
Ini digunakan sebagai katalis dalam beberapa reaksi kimia, seperti dalam persiapan resin urea-formalde. Ini juga berguna sebagai bakteri dan penstabil klorin di kolam renang dan sebagai pemutih pulp kayu di pabrik pulpa dan kertas.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Asam sulfamik. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah
- Williams, d.L.H. (2004) Nitrosasi di pusat nitrogen. Dalam reaksi nitrosasi dan kimia oksida nitrat. Bab 2. Pulih dari scientedirect.com
- Clapp, Leallyn B. (1943). Asam sulfat dan kegunaannya. Chem. Educ. 1943, 20, 4, 189. Pulih dari pub.ACS.org
- McDonald, James. (2003). Asam sulfamik. Pulih dari veoliawaterTech.com
- Sastri, v.S. (2010). Manajemen dan kontrol korosi. Dalam korosi Shreir. Pulih dari scientedirect.com
- Bajpai Pratima. (2018). Topik lain -lain. Dalam buku pegangan Biermann tentang bubur kertas dan kertas. Edisi ketiga. Pulih dari scientedirect.com

