Asam belerang
- 1020
- 245
- Irvin Reichel
 Asam belerang adalah asam mineral yang terjadi ketika sulfur dioksida larut dalam air
Asam belerang adalah asam mineral yang terjadi ketika sulfur dioksida larut dalam air Apa itu asam belerang?
Dia Asam belerang Itu adalah oxácido yang terbentuk saat belerang dioksida, jadi2, larut dalam air. Ini adalah asam anorganik yang lemah dan tidak stabil, yang tidak dapat dideteksi dalam larutan, karena reaksi pembentukannya reversibel dan asam terurai dengan cepat dalam reagen yang menghasilkannya (demikian2 dan h₂o).
Ini adalah cairan yang tidak berwarna, dengan aroma sulfur yang kuat, tidak stabil, dan digunakan di berbagai bidang industri, seperti bahan bernoda klorin, untuk sintesis produk obat dan kimia, untuk pembuatan kertas, atau untuk memperbaiki turunan minyak bumi.
Molekul asam belerang saat ini hanya terdeteksi dalam fase gas. Basa terkonjugasi asam ini adalah anion umum di bawah bentuk sulfit dan bisulfit.
Spektrum solusi SO Raman2 Itu hanya menunjukkan tanda -tanda karena molekul SO2 dan ion bisulfit, hso3-, Konsisten dengan saldo berikut:
Sw2 + H₂o hso3- + H+
Ini menunjukkan bahwa dengan spektrum Raman tidak mungkin.
Saat terpapar ke atmosfer, itu dengan cepat diubah menjadi asam sulfat. Asam belerang dikurangi menjadi hidrogen sulfida karena aksi asam sulfat dan seng yang diencerkan.
Upaya untuk memusatkan solusi SO2 Dengan penguapan air untuk mendapatkan asam sulfur bebas air, ia tidak menghasilkan hasil, karena asam terurai dengan cepat (menginvestasikan reaksi pembentukan), sehingga asam tidak dapat diisolasi.
Struktur dari Asam belerang
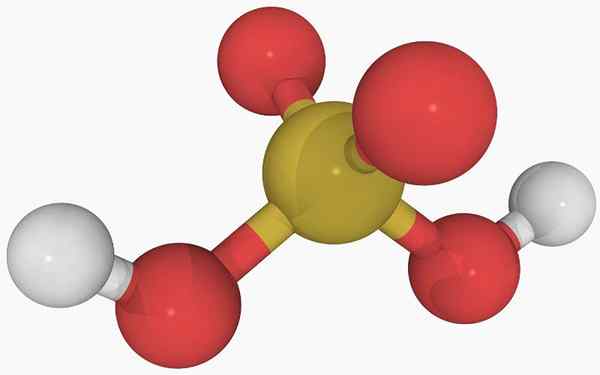
 Struktur kimia asam belerang
Struktur kimia asam belerang Pada gambar utama struktur molekul asam belerang yang terisolasi dalam keadaan gas dapat dilihat. Bola kuning di tengah sesuai dengan atom belerang, merah ke atom oksigen, dan putih ke hidrogen.
Dapat melayani Anda: diastreomerGeometri molekulnya di sekitar atom S adalah piramida trigonal, dengan atom atau menarik dasar.
Kemudian, dalam keadaan gas, molekul H2Sw3 Mereka dapat dianggap sebagai piramida trigonal mikroskopis yang mengambang di udara, dengan asumsi bahwa mereka cukup stabil untuk bertahan beberapa waktu tanpa bereaksi.
Strukturnya membuatnya jelas dari mana dua hidrogen asam berasal: dari gugus hidroksil yang terkait dengan sulfur, ho-oh-oh. Oleh karena itu, untuk senyawa ini, tidak benar untuk mengasumsikan bahwa salah satu proton asam, h+, dilepaskan dari atom belerang, h-so2(OH).
Dua gugus OH memungkinkan asam sulfur berinteraksi menggunakan jembatan hidrogen, dan juga oksigen dari ikatan S = O adalah akseptor hidrogen, yang membuat H2Sw3 baik dalam donor yang baik dan akseptor jembatan ini.
Menurut hal di atas, h2Sw3 Saya harus bisa mengembun dalam cairan, seperti asam sulfat, h2Sw4. Namun demikian, bukan itu yang terjadi.
Sifat fisik dan kimia dari Asam belerang
Formula molekul
H2Sw3
Berat molekul
82.073 g/mol.
Penampilan fisik
Itu adalah cairan yang tidak berwarna, dengan bau belerang pedas.
Kepadatan
1.03 g/ml.
Kepadatan uap
2.3 (sehubungan dengan udara yang diambil sebagai 1)
Korosivitas
Ini korosif untuk logam dan jaringan.
Kelarutan air
Keliru.
Kepekaan
Itu sensitif udara.
Stabilitas
Stabil, tetapi tidak sesuai dengan basis yang kuat.
Konstanta Keasaman (KA)
1.54 x 10-2
PKA
1.81
ph
1.5 pada skala pH.
titik pengapian
Tidak mudah terbakar.
Penguraian
Saat dipanaskan, asam belerang dapat dipecah, memancarkan asap beracun sulfur oksida.
Dapat melayani Anda: kromium hidroksida: struktur, sifat, sintesis, penggunaanTata nama
Sulfur memiliki valensi berikut: ± 2, +4 dan +6. Dari formula h2Sw3, Dapat dihitung valensi atau bilangan oksidasi mana yang memiliki belerang dalam senyawa. Untuk melakukan ini, itu cukup untuk menyelesaikan jumlah aljabar:
2 (+1) + 1V + 3 (-2) = 0
Karena itu adalah senyawa netral, jumlah beban atom yang membentuknya harus 0. Membersihkan V untuk persamaan sebelumnya, Anda memiliki:
V = (6-2)/1
Dengan demikian, v sama dengan +4. Yaitu, sulfur berpartisipasi dengan Valencia keduanya, dan menurut nomenklatur tradisional, akhiran harus ditambahkan ke nama -ooso. Karena alasan ini, untuk h2Sw3 Itu dikenal sebagai asam belerangberuang.
Cara lain yang lebih cepat untuk menentukan valencia ini, adalah membandingkan h2Sw3 dengan h2Sw4.
Dalam h2Sw4 Belerang memiliki valencia +6, jadi jika satu atau, valencia turun ke +4, dan jika yang lain dihapus, Valencia turun ke +2 (yang akan menjadi kasus asam cegukanSulfurberuang, H2Sw2).
Meskipun kurang dikenal, untuk h2Sw3 Ini juga dapat disebut asam trioxosulfurat (IV), menurut nomenklatur stok.
Pembentukan asam belerang di alam
Asam belerang terbentuk di alam karena kombinasi sulfur dioksida, produk dari aktivitas pabrik besar, dengan air atmosfer.
Untuk alasan ini, ini dianggap sebagai produk perantara dari hujan asam, menyebabkan kerusakan besar pada pertanian dan lingkungan.
Perpaduan
Secara teknis, belerang terbentuk untuk membentuk sulfur dioksida. Kemudian, larut dalam air untuk membentuk asam belerang. Namun, reaksinya reversibel dan asam dengan cepat mematahkan kembali reaktan.
Ini adalah penjelasan mengapa asam sulfur tidak ditemukan dalam larutan air (seperti yang telah disebutkan dalam bagian struktur kimianya).
Dapat melayani Anda: Hukum Beer-LambeAplikasi
Secara umum, penggunaan dan aplikasi asam belerang, karena kehadirannya tidak dapat dideteksi, merujuk pada penggunaan dan aplikasi sulfur dioksida dan basa dan garam asam.
Di hutan
Dalam proses sulfit, pulp kayu dalam bentuk serat selulosa yang hampir murni terjadi. Beberapa garam asam sulfur digunakan untuk ekstraksi lignin dari serpihan kayu, menggunakan wadah bertekanan tinggi yang disebut pencator.
Agen desinfektan
Asam belerang digunakan sebagai desinfektan.
Pemutih
Ini juga digunakan sebagai pemutih lembut, terutama untuk bahan sensitif klorin. Selain itu, digunakan sebagai pemutih gigi dan aditif makanan.
Kosmetik
Ini adalah bahan dari berbagai kosmetik untuk perawatan kulit dan digunakan sebagai elemen pestisida dalam penghapusan tikus. Menghilangkan noda yang disebabkan oleh anggur atau buah -buahan di berbagai kain.
Antiseptik
Itu berfungsi sebagai antiseptik, efektif untuk menghindari infeksi kulit. Dalam beberapa saat, itu digunakan dalam fumigasi untuk mendisinfeksi kapal, barang -barang korban epidemi, dll.
Agen pengawet
Asam belerang digunakan sebagai pengawet buah dan sayuran dan untuk menghindari fermentasi minuman seperti anggur dan bir, menjadi elemen antioksidan, antibakteri dan fungisida.
Produk kimia
Asam belerang digunakan dalam sintesis obat dan bahan kimia, dalam elaborasi anggur dan bir, dalam penyempurnaan produk yang diturunkan minyak, dan sebagai reagen analitik.
Referensi
- Nomenklatur asam. Pulih dari 2.Kimia.Gatech.Edu
- Calvo Flores, F. G. Formulasi Kimia Anorganik. UGR pulih.adalah

