Enzim kinetik
- 2715
- 255
- Miss Marion Graham
Apa itu kinetika enzimatik?
Itu Enzim kinetik Ini adalah bidang studi di mana fisikokimia dan biokimia bertemu untuk mempelajari reaksi kimia yang dikatalisis oleh enzim. Enzim adalah katalis biologis yang meningkatkan kecepatan reaksi kimia dengan mengurangi energi aktivasi mereka.
Enzim mengkatalisasi reaksi kimia yang sangat penting untuk pemeliharaan kehidupan. Mereka memiliki pH dan suhu optimal untuk melakukan tindakan katalitik mereka pada substrat, sehingga mereka adalah faktor penting dalam studi kegiatan mereka.
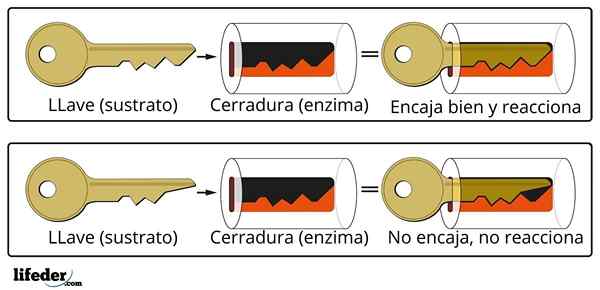
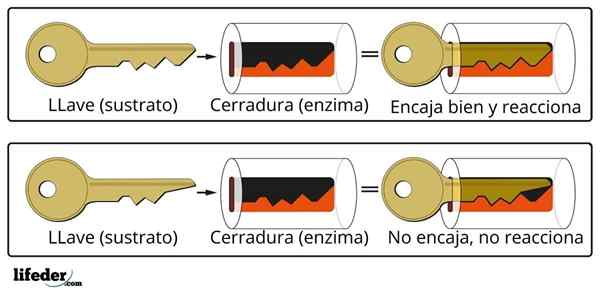 Sistem Penutupan Kunci adalah perkiraan analogi dengan sistem substrat-enzim.
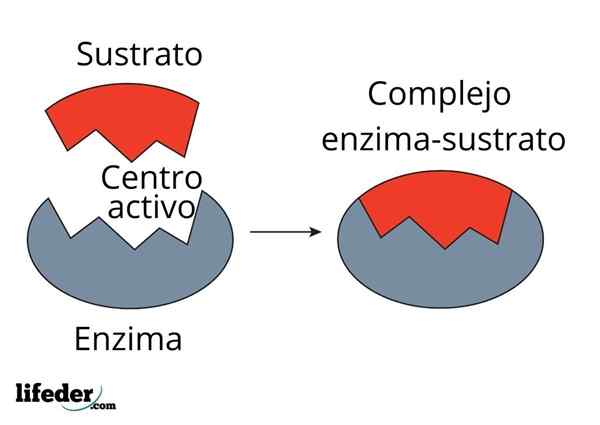
Sistem Penutupan Kunci adalah perkiraan analogi dengan sistem substrat-enzim. Enzim berinteraksi dengan substrat melalui daerah khusus dari rantai proteinnya, yang disebut pusat aktif, yang struktur tiga dimensi digabungkan dengan struktur substrat. Interaksi antara pusat aktif dan substrat biasanya lemah dan tidak kovalen.
Jumlah pusat enzim aktif terbatas, menghasilkan saturasi dengan molekul substrat, yang pada gilirannya mencegah kecepatan reaksi dari peningkatan di luar nilai tertentu, yang dikenal sebagai kecepatan maksimum.
Kinetika enzimatik tidak hanya menggabungkan biokimia dan fisikokimia, tetapi juga bioinorganik, kimia supramolekul, kimia komputasi, dan statistik.
Di antara model -model yang menggambarkannya adalah michaelis -resist. Hari ini masih merupakan salah satu model yang paling sering digunakan untuk menggambarkan kinetika enzimatik.
Konsep Dasar dalam Kinetika Enzimatik
Katalisis enzimatik
Enzim adalah protein, dengan aktivitas katalitik, mampu bertindak pada molekul yang disebut substrat, mengkatalisasi transformasi menjadi zat lain yang dikenal sebagai produk. Enzim tidak dikonsumsi selama aksi katalitiknya, tetap menjadi massa konstan mereka.
Aktivitas katalitik
Aktivitas katalitik enzim dilakukan dalam struktur tiga dimensi khusus yang dikenal sebagai pusat aktif. Ini dibentuk oleh lipatan rantai protein enzimatik yang menentukan interaksi sekelompok asam amino yang membentuk pusat aktif.
Pusat Aktif
Pusat aktif bukanlah struktur yang kaku, tetapi mampu beradaptasi secara geometris dengan substrat untuk berinteraksi dengannya. Interaksi umumnya lemah (gaya van der Waals), meskipun ada enzim yang membentuk hubungan kovalen dengan substrat.
Dapat melayani Anda: Lemak butyric: memperoleh, jenis, komposisi, penggunaan, manfaatPenurunan energi aktivasi
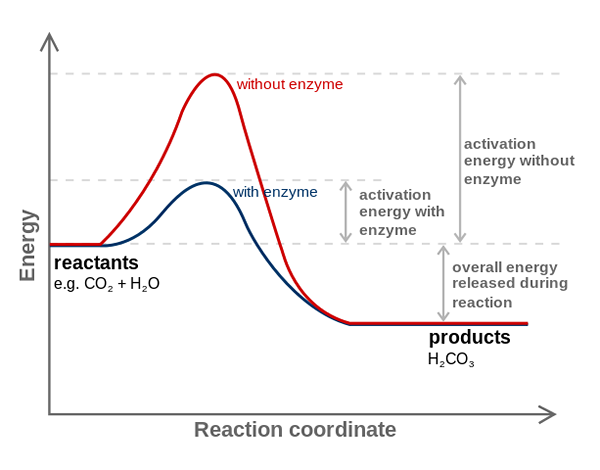 Enzim anhidrase karbonik mengurangi energi aktivasi untuk konversi CO2 ke H2CO3. Sumber: fvasconcellos (bicara • contribs), cc by-sa 3.0, via Wikimedia Commons
Enzim anhidrase karbonik mengurangi energi aktivasi untuk konversi CO2 ke H2CO3. Sumber: fvasconcellos (bicara • contribs), cc by-sa 3.0, via Wikimedia Commons Enzim mengkatalisasi reaksi mengurangi energi aktivasi, dan oleh karena itu, juga mengurangi konsumsi energi bebas (g) yang diperlukan untuk penyelesaian proses yang dikatalisis. Enzim tidak memodifikasi titik kesetimbangan reaksi kimia yang tidak katalakan.
Perhatikan bagaimana enzim anhidrase karbonik mengurangi energi aktivasi untuk konversi co2 untuk h2BERSAMA3. Meskipun jarak antara garis merah dan kebiruan tampaknya tidak banyak, enzim ini meningkatkan kecepatan dalam urutan jutaan kali (106), dibandingkan dengan reaksi yang dilakukan tanpa partisipasi mereka.
Stereoespecificity
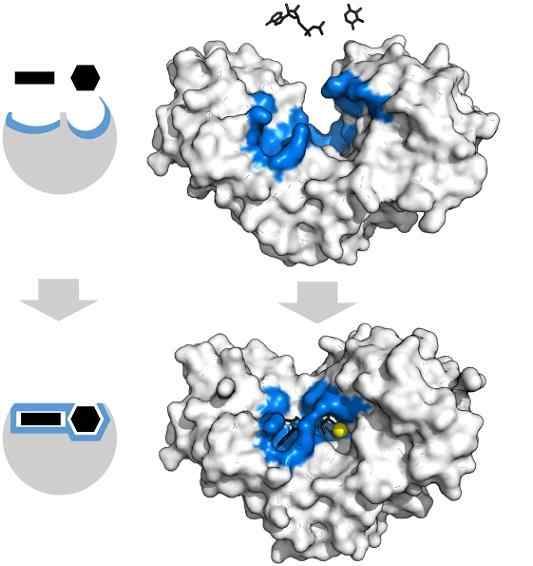 Substrat adenosin tryphosphate dan xylose memiliki bentuk spesifik yang bertepatan dengan geometri pusat aktif enzim hexoquinase. Sumber: Thomas Shafee, CC oleh 4.0, via Wikimedia Commons
Substrat adenosin tryphosphate dan xylose memiliki bentuk spesifik yang bertepatan dengan geometri pusat aktif enzim hexoquinase. Sumber: Thomas Shafee, CC oleh 4.0, via Wikimedia Commons Enzim, secara umum, sangat spesifik untuk reaksi yang mereka katalisasi, karena molekul substrat harus berinteraksi dengan pusat aktif yang menyajikan serangkaian persyaratan untuk kopling mereka dengannya.
Dengan demikian, misalnya, pusat aktif hexoquinase, yang dinamis karena getaran molekul rantai protein, menawarkan kelompok dalam orientasi spasial yang tepat sehingga molekul adenosin dan adenosin xilosa, kapur seolah -olah mereka adalah potongan geometris yang mengisi geometris,.
Gangguan fisik atau kimia sekecil apa pun, dan wilayah biru -hexoquinase tidak dapat lagi mengakomodasi substrat.
Kecepatan maksimum
Enzim memiliki sejumlah pusat aktif, jadi dengan meningkatkan konsentrasi substrat. Ini menentukan bahwa kecepatan reaksi yang dikatalisis tidak dapat meningkat melampaui nilai tertentu, yang dikenal sebagai kecepatan maksimum.
Sensitivitas suhu dan pH
Aktivitas katalitik enzimatik tergantung pada suhu dan pH, memiliki nilai optimal parameter ini untuk operasinya. Demikian juga, karena itu adalah molekul protein enzim, mereka rentan terhadap denaturasi kimia atau termal.
Kofaktor
Beberapa enzim meningkatkan aktivitas katalitiknya karena pengaruh faktor -faktor tertentu, yang dapat berupa logam atau senyawa organik yang dikenal sebagai koenzim.
Demikian juga, enzim dapat dihambat secara kompetitif dan tidak kompetitif. Dalam kasus hexoquinase dari atas, mg2+ (Sphere Kuning) bertindak sebagai kofaktor.
Laju reaksi enzimatik
Kecepatan reaksi enzimatik tergantung pada konsentrasi substrat dan konsentrasi enzimatik. Saat konsentrasi substrat rendah, ada hubungan yang hampir linier antara kecepatan enzimatik dan konsentrasi substrat.
Itu dapat melayani Anda: tidak ada logam: sejarah, properti, grup, penggunaanOleh karena itu, kecepatan enzimatik meningkat dalam proporsi langsung dengan konsentrasi substrat; Tetapi dengan meningkatkan konsentrasi substrat ke nilai yang memenuhi situs aktif enzim, kecepatan maksimum tercapai.
Setelah kecepatan enzimatik terjadi, ia menjadi konstan, yaitu, tidak tergantung pada konsentrasi substrat dan dikatakan bahwa kecepatan enzimatik adalah nol. Selain itu, kecepatan enzimatik katalitik sebanding dengan konsentrasi kompleks enzim-substrat [IS].
Seperti yang ditunjukkan oleh ekspresi matematika:
V = k2[ADALAH]
Kecepatan maksimum berbanding lurus dengan konsentrasi total enzim, seperti yang muncul dalam formula berikut:
VMax = KKucingDANT
KKucing Ini adalah nomor rotasi atau penggantian dan mewakili jumlah molekul substrat yang masing -masing situs enzimatik diubah menjadi produk per unit waktu. KetikaT mewakili jumlah situs enzimatik katalitik. YaT Ini memiliki nilai tinggi, [S] yang lebih tinggi diperlukan untuk memenuhi situs atau pusat aktif.
Persamaan Michaelis -Mente
Model
Model Mihaelis -mente didasarkan pada aksi enzim yang bertindak pada substrat sederhana dan tidak berlaku untuk enzim alosterik; yaitu, yang memiliki wilayah pengatur aktivitas katalitik dari situs aktif.
Enzim pada konsentrasi substrat yang rendah, memiliki aktivitas katalitik yang linier dengan konsentrasi substrat; Tetapi pada konsentrasi substrat tinggi, aktivitas katalitik tidak tergantung pada konsentrasi substrat.
Pada tahun 1913, Leonor Michelis dan Maud Minded mengusulkan model untuk menjelaskan perilaku enzimatik yang ditunjukkan, keberadaan kompleks perantara enzim-sustrato [adalah] yang penting dalam model [IS].
Persamaan Umum
Hubungan kompleks ini dengan komponen lain dari proses enzimatik, serta dengan konstanta (k) yang menghubungkannya, ditunjukkan dalam skema berikut:
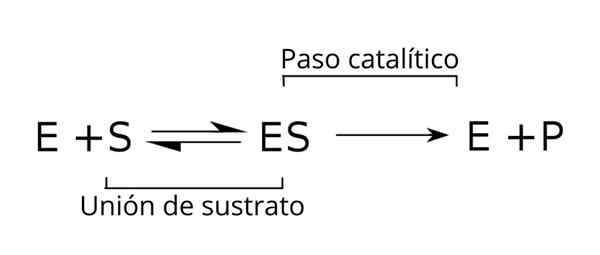 Persamaan Umum Substrat, Kompleks Enzim-Substrat dan Produk Kinetika Enzimatik. Sumber: Tim Vickers via Wikipedia.
Persamaan Umum Substrat, Kompleks Enzim-Substrat dan Produk Kinetika Enzimatik. Sumber: Tim Vickers via Wikipedia. Enzim (E) dikombinasikan dengan substrat untuk membentuk kompleks enzim-substrat dengan konstanta K-kecepatan1. Kompleks E-S dapat terdisosiasi dalam E dan S dengan konstanta kecepatan reaksi k-1.
Demikian juga, kompleks ini dapat menyebabkan produk (P) dan pemisahan enzim, yang dapat didaur ulang untuk memenuhi siklus aktivitas enzimatik lainnya. Situasi keseimbangan dapat dicapai untuk negara [adalah] di mana kecepatan pembentukannya sama dengan kecepatan dekomposisi.
Itu dapat melayani Anda: elemen kimia alamiK1[Is] [s] = (k-1 + K2) [IS] (1)
Menggabungkan istilah dan kliring [adalah], Anda memiliki:
[Is] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM Ini adalah konstan yang diperkenalkan oleh Michaelis.
Ketentuan Persamaan Michaelis -mente
Mengganti sekarang kM Dalam (2) kami melanjutkan:
[Is] = [e] [s] / kM (3)
Konsentrasi enzim non -kombinasi adalah:
[E] = [eT] - [es] (4)
Di mana [e] adalah enzim bebas dan [eT] Konsentrasi total enzim.
Menggabungkan persamaan 3 dan 4, membuat substitusi jatuh tempo, dan juga memperhitungkan vMax, Persamaan Michaelis-Muene tercapai, diekspresikan dengan cara berikut:
V = (vMax [S]) / ([s] + kM)
Kecepatan maksimum reaksi enzimatik terjadi ketika konsentrasi substrat jauh lebih besar dari kM Dan situs katalitik enzim jenuh dengan substrat. Ini terjadi ketika hubungan [s]/[s] + kM Pendekatan ke 1.
Ketika [s] sama dengan kM, Bagian dari persamaan [s] / [s] + kM sama dengan 1/2, menunjukkan bahwa kM Konsentrasi substrat yang menghasilkan laju reaksi enzimatik yang setengahnya kecepatan maksimum.
Selain itu, kM Ini adalah ukuran afinitas enzim oleh substrat: semakin besar nilai kM, minor akan menjadi afinitas enzim untuk substrat dan sebaliknya. Oleh karena itu, ke kM tinggi kecepatan reaksi enzimatik akan rendah.
Grafik Burk Lineweaver
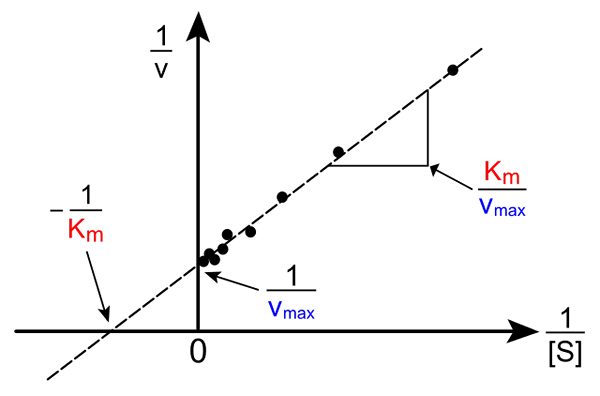 Lineweaver-Burk Straight. Sumber: Pro Bug Catcher via Wikipedia.
Lineweaver-Burk Straight. Sumber: Pro Bug Catcher via Wikipedia. Transformasi persamaan Michaelis-Muene untuk menghasilkan bentuk terbalik memiliki bentuk berikut:
1/v = (kM / VMax) (1 / [s]) + 1 / vMax
Pentingnya garis ini adalah bahwa ia memiliki persimpangan dengan sumbu x di - 1/kM, dan dengan sumbu y pada y = 1/vMax (gambar atas). Garis memiliki kemiringan kM/Vmax. Ini memungkinkan informasi tentang vMax dan kM Membukut kebalikan dari kecepatan tergantung pada kebalikan dari konsentrasi substrat.
Referensi
- Strayer, l. (1975). Biokimia. 2memberi Edisi. Editorial dikembalikan.
- Iran. Levine. (2009). Prinsip -prinsip fisikokimia. Edisi Keenam. MC Graw Hill.
- Wikipedia. (2020). Kinetika enzim. Diperoleh dari: di.Wikipedia.org
- Michael Blaber. (5 Juni 2019). Kinetika enzim. Libretteks biologi. Pulih dari: bio.Librettexts.org
- Para editor Eeritlopaedia Britannica. (2020). Kinetika Michaelis-Muen. Dipulihkan dari: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biokimia. Edisi ke -5. New York: W H Freeman; (2002). Bagian 8.4: Akun Model Michaelis untuk Sifat Kinetik dari banyak enzim. Pulih dari: ncbi.Nlm.Nih.Pemerintah

