Sejarah klorin, sifat, struktur, risiko, penggunaan

- 3483
- 895
- Tommie Smith
Dia klorin Itu adalah elemen kimia yang diwakili oleh simbol CL. Ini adalah yang kedua dari halogen, yang terletak di bawah fluor, juga merupakan elemen paling elektronegatif ketiga dari semuanya. Namanya berasal dari warna hijau kekuningannya, yang lebih intens daripada fluorine.
Populer ketika seseorang mendengarkan nama mereka apa yang pertama kali pikirkan dalam produk pemutihan untuk pakaian, dan di air kolam. Meskipun klorin beroperasi secara efektif dalam contoh -contoh seperti itu, itu bukan gasnya, tetapi senyawanya (terutama hipoklorit) yang mengerahkan tindakan dekolorasi dan desinfektan.
 Labu bundar dengan gas gaseous di dalam. Sumber: Larenmclane [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)]
Labu bundar dengan gas gaseous di dalam. Sumber: Larenmclane [CC BY-SA 4.0 (https: // createveCommons.Org/lisensi/by-sa/4.0)] Pada gambar atas labu bundar dengan gas klorin ditampilkan. Kepadatannya lebih besar dari pada udara, yang menjelaskan mengapa ia tetap berada di labu dan tidak lepas dari atmosfer; Seperti halnya gas yang lebih ringan lainnya, untuk mengatakan helium atau nitrogen. Dalam keadaan ini adalah zat yang sangat beracun, karena menghasilkan asam klorida di paru -paru.
Itulah sebabnya klorin dasar atau gas tidak memiliki terlalu banyak kegunaan, lebih dari pada beberapa sintesis. Namun, senyawanya, apakah garam atau molekul organik terklorinasi, memang menutupi repertoar penggunaan yang baik, menempatkan di luar kolam dan pakaian putih ekstrem.
Juga, atom -atomnya dalam bentuk anion klorida ada di dalam tubuh kita, mengatur kadar natrium, kalsium dan kalium, serta jus lambung. Jika tidak, asupan natrium klorida akan lebih mematikan.
Klorin terjadi melalui elektrolisis air garam, kaya natrium klorida, proses industri di mana natrium dan hidrogen hidroksida juga diperoleh. Dan karena lautan adalah sumber garam ini yang hampir tidak ada habisnya, cadangan potensial elemen ini di hidrosfer sangat besar.
[TOC]
Sejarah
Pendekatan pertama
Karena tingginya reaktivitas klorin gas, peradaban kuno tidak pernah mencurigai keberadaan mereka. Namun, senyawa mereka adalah bagian dari budaya kemanusiaan dari masa lalu; Sejarahnya mulai terkait dengan garam biasa.
Di sisi lain, klorin muncul dari letusan gunung berapi dan ketika seseorang melarutkan emas dalam air kerajaan; Tetapi tidak ada pendekatan pertama yang cukup untuk merumuskan gagasan bahwa gas hijau kekuningan ini adalah elemen majemuk.
Penemuan
Penemuan klorin disebabkan oleh ahli kimia Swedia Carl Wilhelm Scheele, yang pada 1774 membuat reaksi antara mineral pirolusit dan asam klorida (saat itu disebut asam muriatik).
Scheele tetap dengan kredit karena ia adalah ilmuwan pertama yang mempelajari sifat -sifat klorin; Meskipun dia sebelumnya diakui (1630) oleh Jan Baptist Van Helmont.
Eksperimen dengan mana Scheele memperoleh pengamatannya menarik: ia mengevaluasi aksi dekolorasi klorin pada bunga -bunga bunga kemerahan dan kebiruan, serta di daun tanaman dan serangga yang mati secara instan.
Dia juga memberi tahu reaktifnya yang tinggi terhadap logam, baunya yang mencekik dan efek yang tidak diinginkan pada paru -paru, dan ketika dia larut dalam air, keasamannya meningkat.
Asam oimuriatik
Pada saat itu, bahan kimia dianggap sebagai asam untuk semua senyawa yang memiliki oksigen; Jadi mereka melewatkan klorin harus berupa oksida gas. Itu agar mereka menyebutnya 'asam oksiuriatik' (asam oksida muriatik), nama yang diciptakan oleh ahli kimia Prancis yang terkenal Antoine Lavoisier.
Kemudian, pada tahun 1809 Joseph Louis Gay-Lussac dan Louis Jacques Thénard mencoba mengurangi asam karbon ini; reaksi diperoleh dengan logam dari oksida mereka. Dengan cara ini, mereka ingin mengekstraksi unsur kimia dari dugaan asam oksimuriatik (yang mereka sebut 'udara deflistik asam muriatik'.
Namun, Gay-Lussac dan Thénard gagal dalam eksperimen mereka; Tetapi mereka berhasil ketika mempertimbangkan bahwa gas hijau kekuningan itu harus menjadi elemen kimia dan bukan senyawa.
Pengakuan sebagai elemen
Pengakuan klorin sebagai unsur kimia berkat Sir Humphry Davy, yang pada tahun 1810 melakukan eksperimennya sendiri dengan elektroda batubara dan menyimpulkan bahwa memang ada oksida asam muriatik seperti itu.
Dan selain itu, Davy yang menciptakan nama 'klorin' untuk elemen ini dari kata Yunani 'chloros', yang berarti kekuningan.
Ketika mereka mempelajari sifat kimia klorin, ditemukan bahwa banyak senyawa mereka memiliki sifat garam; Oleh karena itu, mereka menamainya sebagai 'halogen', yang berarti formator penjualan. Kemudian, istilah halogen digunakan dengan elemen lain dari kelompok yang sama (F, BR dan I).
Michael Faraday bahkan berhasil mencair2· H2SALAH SATU.
Dapat melayani Anda: beban nuklir yang efektifSisa sejarah klorin terkait dengan sifat desinfektan dan pemutihannya, dengan pengembangan proses industri elektrolisis air garam untuk menghasilkan sejumlah besar klorin.
Sifat fisik dan kimia
Penampilan fisik
Ini adalah gas padat hijau kekuningan yang buram, aroma acre yang menjengkelkan (versi super intensif dari klorin komersial) dan juga sangat beracun.
Nomor Atom (Z)
17
Berat atom
35,45 u.
Kecuali dinyatakan sebaliknya, sisa sifatnya sesuai dengan besaran yang diukur untuk molekul klorin, CL2.
Titik didih
-34.04 ºC
Titik lebur
-101.5 ºC
Kepadatan
-Dalam kondisi normal, 3,2 g/l
-Tepat di titik didih, 1.5624 g/ml
Perhatikan bahwa klorin cair sekitar lima kali lebih banyak dari gasnya. Juga, kepadatan uapnya 2,49 kali lebih besar dari udara. Itulah sebabnya pada gambar pertama klorin tidak cenderung melarikan diri dari labu bundar, karena lebih padat daripada udara terletak di latar belakang. Fitur ini masih membuat gas yang lebih berbahaya.
Panas fusi
6.406 kJ/mol
Panas penguapan
20.41 kJ/mol
Kapasitas panas molar
33.95 J/(mol · k)
Kelarutan air
1.46 g/100 ml pada 0 ºC
Tekanan uap
7.67 ATM pada 25 ºC. Tekanan ini relatif rendah dibandingkan dengan gas lain.
Elektronegativitas
3.16 Pada skala Pauling.
Energi ionisasi
-Pertama: 1251.2 kJ/mol
-Kedua: 2298 kJ/mol
-Ketiga: 3822 kJ/mol
Konduktivitas termal
8.9 · 10-3 W/(m · k)
Isotop
Klorin terjadi di alam terutama sebagai dua isotop: 35Cl, dengan kelimpahan 76%, dan 37Cl, dengan berlimpah 24%. Dengan demikian, berat atom (35,45 U) adalah rata -rata massa atom dari dua isotop ini, dengan persentase kelimpahan masing -masing.
Semua radioisotop klorin adalah buatan, di antaranya 36Cl sebagai yang paling stabil, dengan setengah kehidupan 300.000 tahun.
Angka oksidasi
Klorin dapat memiliki beberapa angka atau keadaan oksidasi ketika itu adalah bagian dari senyawa. Menjadi salah satu atom paling elektronegatif dalam tabel periodik, biasanya memiliki angka oksidasi negatif; Kecuali jika berjalan dengan oksigen atau fluor, masing -masing oksida dan fluorida, ia harus "kehilangan" elektron.
Dalam bilangan oksidasinya keberadaan atau adanya ion dengan besarnya beban diasumsikan. Jadi, kita memiliki: -1 (cl-, Anion klorida yang terkenal), +1 (cl+), +2 (cl2+), +3 (cl3+), +4 (cl4+), +5 (cl5+), +6 (cl6+) dan +7 (cl7+). Dari semua, -1, +1, +3, +5 dan +7 adalah yang paling umum ditemukan dalam senyawa terklorinasi.
Sebagai contoh, di CLF dan CLF3 Angka oksidasi untuk klorin adalah +1 (cl+F-) dan +3 (cl3+F3-). Di cl2Atau, ini +1 (cl2+SALAH SATU2-); saat berada di CLO2, Cl2SALAH SATU3 dan Cl2SALAH SATU7, Son +4 (CL4+SALAH SATU22-), +3 (cl23+SALAH SATU32-) dan +7 (cl27+SALAH SATU72-).
Di semua klorida, di sisi lain, klorin memiliki jumlah oksidasi -1; Seperti dalam kasus NaCl (NA+Cl-), Di mana valid untuk mengatakan bahwa CL ada- Mengingat sifat ionik dari garam ini.
Struktur dan konfigurasi elektronik
Molekul klorin
 Molekul klorin diatomik diwakili dengan model pengisian ruang. Sumber: Benjah-BMM27 via Wikipedia.
Molekul klorin diatomik diwakili dengan model pengisian ruang. Sumber: Benjah-BMM27 via Wikipedia. Atom klorin dalam keadaan basal mereka memiliki konfigurasi elektronik berikut:
[Ne] 3s2 3p5
Oleh karena itu, masing -masing memiliki tujuh elektron Valencia. Kecuali jika mereka kelebihan energi, akan ada atom individu di ruang angkasa, seolah -olah mereka adalah kelereng hijau. Namun, kecenderungan alaminya adalah membentuk ikatan kovalen di antara mereka, untuk menyelesaikan oktet Valencia mereka.
Perhatikan bahwa mereka hampir tidak membutuhkan elektron untuk memiliki delapan elektron valensi, sehingga mereka membentuk satu tautan sederhana; Ini, yang bergabung dengan dua atom CL untuk membuat molekul CL2 (gambar atas), CL-Cl. Itulah sebabnya klorin dalam kondisi normal dan/atau terestrial adalah gas molekuler; non -monoatomik, seperti halnya dengan gas mulia.
Interaksi antarmolekul
The Molecula Cl2 Ini adalah homonuklear dan apolar, sehingga interaksi antar molekulnya diatur oleh kekuatan dispersi London dan massa molekulnya. Dalam fase soda, jarak cl2-Cl2 Ini relatif singkat dibandingkan dengan gas lain yang, menambahkan massanya, menjadikannya gas tiga kali lebih banyak dari udara.
Cahaya dapat menggairahkan dan mempromosikan transisi elektronik dalam orbital molekul CL2; Akibatnya, warna hijau kekuningannya muncul. Warna ini semakin meningkat dalam keadaan cair, dan kemudian sebagian menghilang saat menguatkan.
Dapat melayani Anda: basis lemahSaat suhu turun (-34 ºC), molekul CL2 Mereka kehilangan energi kinetik dan jarak cl2-Cl2 berkurang; Oleh karena itu, mereka kohesif dan akhirnya mendefinisikan klorin cair. Hal yang sama terjadi ketika sistem (-101 ºC) lebih didinginkan, sekarang dengan molekul CL2 Jadi bersama -sama yang mendefinisikan kristal ortorombik.
Fakta bahwa ada kristal klorin merupakan indikasi bahwa kekuatan dispersifnya cukup terarah untuk menciptakan pola struktural; Ini, lapisan molekul CL2. Pemisahan lapisan -lapisan ini sedemikian rupa sehingga bahkan di bawah tekanan 64 GPa strukturnya dimodifikasi, juga tidak menunjukkan konduktif listrik.
Dimana itu dan dapatkan
Garam klorida
 Kristal yang kuat dari halita, lebih dikenal sebagai garam umum atau meja. Sumber: Parent Géry [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Kristal yang kuat dari halita, lebih dikenal sebagai garam umum atau meja. Sumber: Parent Géry [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Klorin dalam keadaan gasnya tidak dapat ditemukan di mana pun di permukaan bumi, karena sangat reaktif dan cenderung membentuk klorida. Klorida ini tersebar dengan baik di seluruh kerak bumi dan, selain itu, setelah jutaan tahun diseret oleh hujan, laut dan lautan memperkaya.
Di antara semua klorida, NaCl del Mineral Halita (gambar superior) adalah yang paling umum dan berlimpah; diikuti oleh silvina, kcl, dan carnalita, mineral mgcl2· Kcl · 6h2SALAH SATU. Ketika massa air menguap oleh aksi matahari meninggalkan danau garam gurun, dari mana NaCl dapat diekstraksi secara langsung sebagai bahan baku untuk klorin.
Elektrolisis air garam
NaCl larut dalam air untuk menghasilkan air garam (26%), di mana elektrolisis mengalami sel kloralkalin. Ada dua reaksi semi yang terjadi di kompartemen anoda dan katoda:
2cl-(Ac) => cl2(g) + 2e- (Anoda)
2h2Atau (l) + 2e- => 2OH-(Ac) + h2(g) (katoda)
Dan persamaan global untuk kedua reaksi adalah:
2nacl (ac) + 2h2Atau (l) => 2naOh (ac) + h2(g) + cl2(G)
Saat reaksinya terjadi, ion Na+ dibentuk di anoda yang mereka migrasi ke kompartemen katoda melintasi membran asbes permeabel. Untuk alasan itu, NaOH berada di sisi kanan persamaan global. Kedua gas, CL2 dan H2, Mereka masing -masing dikumpulkan dari anoda dan katoda.
Gambar yang lebih rendah menggambarkan yang baru ditulis:
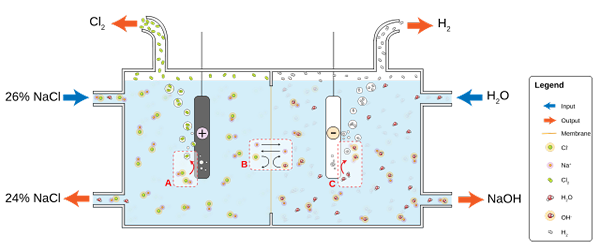 Diagram untuk produksi klorin melalui elektrolisis air garam. Sumber: JKWCHUI [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)]
Diagram untuk produksi klorin melalui elektrolisis air garam. Sumber: JKWCHUI [CC BY-SA 3.0 (https: // createveCommons.Org/lisensi/by-sa/3.0)] Perhatikan bahwa konsentrasi air garam pada akhirnya berkurang 2% (naik dari 24 menjadi 26%), yang berarti bagian dari CL -nya- Asli berubah menjadi molekul CL2. Pada akhirnya industrialisasi proses ini telah memberikan metode untuk menghasilkan klorin, hidrogen dan natrium hidroksida.
Pembubaran asam pirolusit
Seperti yang disebutkan di bagian Sejarah, gaseous klorin dapat diproduksi dengan melarutkan sampel bijih pirolusit dengan asam klorida. Persamaan kimia berikut menunjukkan produk yang diperoleh dari reaksi:
Mne2(s) + 4hcl (ac) => mcl2(Ac) + 2h2Atau (l) + cl2(G)
Paduan
Tidak ada paduan klorin karena dua alasan sederhana: molekul gasnya tidak dapat terperangkap di antara kristal logam, dan ini juga sangat reaktif, sehingga mereka akan segera bereaksi dengan logam untuk menghasilkan klorida masing -masing.
Di sisi lain, klorida juga tidak diinginkan, karena pernah larut dalam air mereka memberikan efek saline yang mempromosikan korosi dalam paduan; Dan karena itu, logam larut untuk membentuk logam klorida. Proses korosi untuk setiap paduan berbeda; Beberapa lebih rentan daripada yang lain.
Klorin, akibatnya, bukan aditif yang baik untuk paduan sama sekali; atau sebagai Cl2 atau seperti Cl- (Dan atom akan sangat reaktif sehingga mereka bahkan bisa ada).
Risiko
Meskipun kelarutan klorin dalam air rendah, itu cukup untuk menghasilkan dalam kelembaban kulit dan mata kita, asam klorida, yang akhirnya merusak jaringan yang menyebabkan iritasi serius dan bahkan hilangnya penglihatan.
Lebih buruk lagi adalah menghirup uap kehijauan kekuningan mereka, karena sekali di paru -paru itu lagi menghasilkan asam dan merusak jaringan paru -paru. Dengan ini, orang tersebut mengalami sakit tenggorokan, batuk dan kesulitan bernapas karena cairan yang terbentuk di paru -paru.
Jika ada pelarian klorin, ia menghadapi situasi yang sangat berbahaya: udara tidak bisa begitu saja "menyapu" uapnya; tetap di sana sampai mereka bereaksi atau bubar perlahan.
Dapat melayani Anda: keseimbangan presisi: karakteristik, fungsi, bagian, penggunaanSelain itu, ini adalah senyawa yang sangat mengoksidasi, sehingga beberapa zat dapat bereaksi secara eksplosif dengannya terhadap kontak sekecil apa pun; Seperti halnya wol baja dan aluminium. Itulah sebabnya di mana ada klorin yang disimpan, semua pertimbangan yang diperlukan harus diambil untuk menghindari risiko api.
Ironisnya, sementara gas gaseous adalah mematikan, anion klorida tidak beracun; Itu dapat dikonsumsi (secukupnya), tidak terbakar, atau bereaksi kecuali dengan fluoride dan reagen lainnya.
Aplikasi
Perpaduan
Sekitar 81 % klorin gas yang diproduksi setiap tahun ditakdirkan untuk sintesis klorida organik dan anorganik. Bergantung pada tingkat kovalensi senyawa-senyawa ini, klorin dapat ditemukan sebagai atom CL belaka dalam molekul organik terklorinasi (dengan ikatan C-CL), atau sebagai ion CL- Dalam beberapa garam klorida (NaCl, CACL2, Mgcl2, dll.).
Masing -masing senyawa tersebut memiliki aplikasinya sendiri. Misalnya, kloroform (CHCL3) dan etil klorida (ch3Ch2Cl) adalah pelarut yang telah digunakan sebagai anestesi inhalasi; Diclorometano (ch2Cl2) dan karbon tetraklorida (CCL4), Untuk bagian mereka, mereka adalah pelarut yang banyak digunakan di laboratorium kimia organik.
Ketika senyawa terklorinasi ini cair, sebagian besar waktu ditakdirkan sebagai pelarut untuk reaksi organik berarti.
Dalam senyawa lain, keberadaan atom klor merupakan peningkatan pada saat dipol, sehingga mereka dapat berinteraksi dalam tingkat yang lebih besar dengan matriks kutub; A yang dibentuk oleh protein, asam amino, asam nukleat, dll., Biomolekul. Dengan demikian, klorin juga memiliki kertas dalam sintesis obat, pestisida, insektisida, fungisida, dll.
Mengenai klorida anorganik, mereka biasanya digunakan sebagai katalis, bahan baku untuk mendapatkan logam dengan elektrolisis, atau sumber ion CL-.
Biologis
Gaseous atau Elementary Chlorine tidak memiliki peran dalam makhluk hidup lebih dari menghancurkan jaringan mereka. Namun, ini tidak berarti bahwa atom mereka tidak dapat ditemukan di dalam tubuh. Misalnya, ion CL- Mereka sangat berlimpah dalam medium seluler dan ekstraseluler, dan membantu mengendalikan tingkat ion Na+ dan ca2+, sebagian besar.
Demikian juga, asam klorida adalah bagian dari jus lambung dengan mana makanan dicerna di lambung; Ion CL -nya-, Di perusahaan h3SALAH SATU+, Tentukan pH mendekati 1 dari sekresi ini.
Senjata kimia
Kepadatan gaseous klorin membuatnya menjadi zat yang mematikan saat tumpah atau dituangkan ke dalam ruang tertutup atau terbuka. Menjadi lebih padat dari udara, arusnya tidak dengan mudah menyeret klorin, jadi tetap untuk waktu yang cukup lama sebelum akhirnya menyebar.
Dalam Perang Dunia I, misalnya, klorin ini digunakan di medan perang. Setelah dilepaskan, ia menyelinap ke parit untuk mati lemas dengan tentara dan memaksa mereka untuk pergi ke permukaan.
Desinfektan
 Kolam dikloronisasi untuk menghindari reproduksi dan penyebaran mikroorganisme. Sumber: Pixabay.
Kolam dikloronisasi untuk menghindari reproduksi dan penyebaran mikroorganisme. Sumber: Pixabay. Larutan kloronisasi, yang ada di mana gaseous klorin telah dilarutkan dalam air dan kemudian dialkalisasi dengan buffer, memiliki sifat desinfektan yang sangat baik, serta menghambat pembusukan jaringan. Mereka telah digunakan untuk mendisinfeksi luka terbuka untuk menghilangkan bakteri patogen.
Air kolam justru dikloronisasi untuk menghilangkan bakteri, mikroba, dan parasit yang dapat menampungnya. Untuk tujuan ini, gaseous klorin dulu digunakan, namun aksinya cukup agresif. Sebaliknya, larutan natrium hipoklorit (pemutih) atau asam trichloroisocianurat (ATC) digunakan (ATC).
Hal tersebut di atas menunjukkan bahwa itu bukan CL2 Orang yang mengerahkan aksi desinfektan tetapi HCLO, asam hipoklorit, yang menghasilkan radikal atau · yang menghancurkan mikroorganisme.
Pemutih
Sangat mirip dengan aksi desinfektannya, klorin juga memutihkan bahan karena warna yang bertanggung jawab untuk HCLO. Dengan demikian, solusi kloronisnya sangat ideal untuk menghilangkan bintik -bintik dari pakaian putih, atau untuk memutihkan kertas kertas.
Polyvinylchloride
Senyawa terklorinasi yang paling penting dari semuanya, yang sekitar 19% dari sisa produksi gaseous klorin dialokasikan, adalah vinil poliklorida (PVC). Plastik ini memiliki banyak kegunaan. Dengan itu, pipa air dibuat, bingkai jendela, dinding dinding dan lantai, kabel listrik, kantong intravena, mantel, dll.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2019). Klorin. Diperoleh dari: di.Wikipedia.org
- Laura h. et al. (2018). Struktur klorin padat pada 1.45 gpazeitschrift für kristallgraphie. Bahan Kristal, Volume 234, Edisi 4, Halaman 277-280, ISSN (Online) 2196-7105, ISSN (Cetak) 2194-4946, doi: doi.org/10.1515/ZKRI-2018-2145
- Pusat Nasional Informasi Bioteknologi. (2019). Klorin. Database pubchem. CID = 24526. Pulih dari: pubchem.NCBI.Nlm.Nih.Pemerintah
- Marques Miguel. (S.F.). Klorin. Pulih dari: nautilus.Fis.UC.Pt
- Dewan Kimia Amerika. (2019). Kimia klorin: Pengantar klorin. Pulih dari: klorin.AmericAchemistry.com
- Fong-yan ma. (S.F.). Efek korosif klorida pada logam. Departemen Teknik Kelautan, Republik Tiongkok (Taiwan).
- Negara Bagian New York. (2019). Fakta tentang klorin. Pulih dari: kesehatan.NY.Pemerintah
- Kata. Doug Stewart. (2019). Fakta Elemen Klorin. Chemicool. Pulih dari: chemicool.com

