Kalsium klorida (CaCl2)
- 1454
- 280
- Frederick Pfeffer
Kami menjelaskan apa kalsium klorida, strukturnya, sifat fisik dan kimianya, bagaimana itu disintesis dan aplikasinya
Apa itu kalsium klorida?
Dia kalsium klorida (CACL2) Ini adalah garam anorganik yang terdiri dari kalsium, logam alkali dan halogen klorin. Di senyawa itu ada beberapa interaksi elektrostatik yang menentukan penampilan eksternal kristal mereka dan sifat fisiknya yang lain.
Ini juga disertai dengan molekul air, membentuk formula umum cocl hydrate2· Xh2Atau, dengan x = 0, 1, 2, 4 dan 6. Saat x = 0, garam tidak memiliki air dan anhidrid, seperti yang ditunjukkan oleh formula kimianya yang disebutkan di atas.
Dalam gambar superior beberapa bagian solid dari CACL diilustrasikan2. Dalam kondisi kelembaban kecil, itu mungkin.
Rumus
Formula kimianya adalah CACL2: Mengekspresikannya untuk setiap ca ion2+ Ada dua ion CL- yang menetralkan beban positif. Kalsium logam -of kelompok 2 dari tabel periodik (SR. Scholambara)- Menghasilkan dua elektronnya untuk setiap atom klorin, elemen kelompok 17.
Struktur kalsium klorida
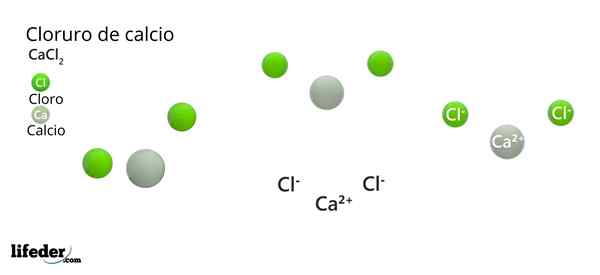
Dalam gambar superior struktur CACL diilustrasikan2 Anhydride. Bola hijau sesuai dengan ion CL-, Sedangkan putih ke ion ca2+. Bola ini difiksasi dalam paralelepiped, yang tidak lebih dari sel ortorombik kesatuan kristal.
Struktur dapat memberikan gagasan palsu bahwa kalsium dominasi; Namun, jika lebih banyak pengulangan sel unit direproduksi, kelimpahan terbesar dari bola hijau akan jelas: ion CL-.
Di sisi lain, ion CA2+ Mereka memiliki radio ionik yang lebih kecil dari ion CL-. Ini karena, ketika mereka kehilangan elektron, inti atom memberikan gaya yang lebih menarik pada lapisan elektronik eksternal, yang mengurangi jari -jari ionik.
Dalam kasus CL-, Ini memiliki elektron tambahan yang tidak dapat tertarik pada gaya yang sama, sehingga meningkatkan jari -jari ioniknya.
Dapat melayani Anda: solusi berairGeometri molekuler dan kompleks kalsium berair
Di tengah paralelepiped CA2+ Itu dikelilingi oleh enam CL-. Empat di antaranya terletak di bidang persegi dan dua lainnya terletak tegak lurus (bola hijau paling terpencil di bola putih).
Sebagai hasil dari pengaturan ion -ion ini, di sekitar CA2+ Octaedro adalah "senjata", sehingga menugaskan geometri molekuler oktahedral.
Mempertimbangkan bagaimana bola hijau diatur, molekul air dapat menggantikan salah satunya, yang terjadi dengan stroke2· H2Atau, mungkin di bidang persegi. Fakta ini memodifikasi struktur kristal dan, saat air menggantikan bola hijau, pengaturan ion berubah lebih banyak.
Saat semua ion CL- Mereka digantikan oleh molekul air, hidrat CaCl terbentuk2· 6h2SALAH SATU. Pada titik ini oktahedron "berair" dan molekul sekarang mampu berinteraksi di antara mereka dengan jembatan hidrogen (CA2+ Oh-h-oh2).
Secara berurutan, kalsium dapat menerima lebih banyak molekul air tanpa mengubah proporsi yang ditetapkan. Ini berarti CACL2· 6h2Atau dapat mengadopsi struktur kompleks lainnya, hingga mempertimbangkan polimer kristal kalsium dan air.
Namun, struktur ini kurang stabil daripada yang didirikan oleh interaksi elektrostatik (CA2+ dan Cl-) dari garam anhidrida.
Penggunaan/aplikasi kalsium klorida
Aplikasi utama kalsium klorida adalah:
- Hindari pembekuan air selama musim dingin. Kalsium klorida menghasilkan sangat panas saat larut dan kemudian, meningkatkan suhu, fusi es terjadi. Untuk alasan ini digunakan untuk mengurangi risiko sirkulasi orang dan kendaraan selama stasiun dingin.
- Membantu mengendalikan debu di jalan yang tidak beraspal.
- Mempercepat kecepatan pengeringan beton setelah dituangkan.
- Cairan Cachl2 Efisiensi pengeboran untuk ekstraksi gas dari deposit bawah tanah mereka meningkat, serta minyak.
- Kolam ditambahkan untuk mengurangi erosi yang diderita oleh beton dindingnya. Kalsium sedimen memenuhi fungsi ini.
- Karena itu adalah garam higroskopis, kalsium klorida dapat digunakan sebagai dispektif, mampu menurunkan kelembaban udara di sekitarnya dan, oleh karena itu, dari zat yang bersentuhan dengan udara itu.
- Ini digunakan sebagai pengawet dalam beberapa makanan, serta aditif dalam beberapa, seperti minuman energi yang digunakan oleh atlet, keju, bir, dll.
- Dalam praktik medis, ia juga memiliki kegunaan dalam pengobatan depresi yang disebabkan oleh overdosis magnesium sulfat, serta dalam keracunan timbal.
Sintesis kalsium klorida
Sumber alami dari senyawa ini adalah salmueras yang diekstraksi dari lautan atau danau.
Namun, sumber utamanya berasal dari proses solvay, di mana batu kapur (Caco3) menderita serangkaian transformasi sampai diturunkan dalam kalsium klorida -produk:
2nacl (aq) + Caco3(s) na2BERSAMA3(S) + CACL2(AC)
Produk yang menarik dari proses ini sebenarnya adalah natrium karbonat, na2BERSAMA3.
Sifat kalsium klorida
Properti fisik dan hidangan lezat
Itu adalah putih, toilet, dan solid higroskopis. Kecenderungan untuk menyerap kelembaban lingkungan ini disebabkan oleh kebesaran ion Ca2+.
Basa seperti apa: Lewis atau Bronsted? Lewis, karena spesies positif mampu menerima elektron. Elektron ini disumbangkan, misalnya, dengan atom oksigen molekul air.
Padatan menyerap kelembaban ke tingkat pelarutan dalam air yang sama yang membasahi kristalnya. Properti ini dikenal sebagai Delicuescencia.
Kepadatannya adalah 2,15 g/ml. Karena memasukkan air ke dalam strukturnya, kristal "melebar", meningkatkan volumenya dan, akibatnya, mengurangi kepadatan. Hanya CACL2· H2O istirahat dengan tren ini, menunjukkan kepadatan yang lebih besar (2,24 g/ml).
Berat molekul garam anhidrida adalah sekitar 111 g/mol, dan untuk setiap molekul air dalam strukturnya, berat ini meningkat 18 unit.
Kelarutan
CACL2 Ini sangat larut dalam air dan dalam beberapa pelarut kutub, seperti etanol, asam asetat, metanol dan alkohol lainnya.
Panas panas
Saat proses dilarutkan dalam air, ia eksotermik dan, oleh karena itu, memanaskan larutan dan lingkungannya.
Dapat melayani Anda: dari mana datangnya plastik? Sejarah dan JenisIni karena kompleks berair lebih baik menstabilkan ion CA2+ dalam solusi interaksi elektrostatik dengan ion CL-. Karena produk lebih stabil, padatan melepaskan energi dalam bentuk panas.
Dekomposisi elektrolitik
CACL2 Cair dapat mengalami elektrolisis, proses fisik yang terdiri dalam pemisahan senyawa dalam elemennya dari aksi arus listrik. Dalam kasus garam ini, produknya adalah kalsium logam dan gas klorin:
CACL2(l) → CA (s) + cl2(G)
Ion ca2+ Mereka dikurangi di katoda, sedangkan cl ion- Mereka teroksidasi di anoda.
Referensi
- Wikipedia. (2018). Kalsium klorida. Diterima dari.Wikipedia.org
- Shiver & Atkins. (2008). Kimia anorganik. Di elemen grup 2. (Edisi keempat., P. 278). MC Graw Hill.
- Pubchem. (2018). Kalsium klorida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Oxychem. Kalsium klorida: Panduan untuk sifat fisik. Oxy pulih.com
- Carole Ann. Penggunaan umum kalsium klorida. Caugher pulih.com