Konfigurasi Elektronik Eksternal
- 4771
- 654
- Tommie Smith
 Orbital Elektronik. Sumber: Patricia.Fidi, Wikimedia Commons
Orbital Elektronik. Sumber: Patricia.Fidi, Wikimedia Commons Apa itu konfigurasi elektronik eksternal?
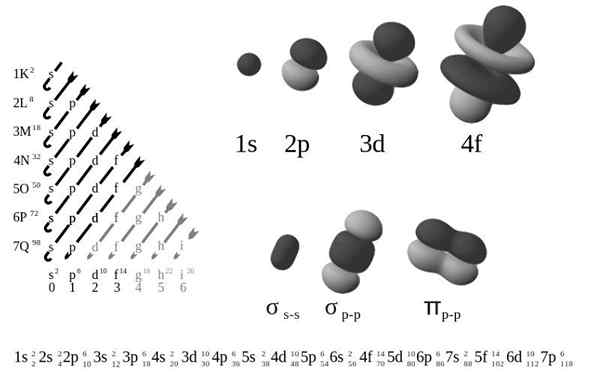
Itu Konfigurasi Elektronik Eksternal, Juga disebut struktur elektronik, itu adalah susunan elektron pada tingkat dan sub -tingkat energi di sekitar inti atom. Levelnya dari 1 hingga 7, dan sub -levelnya adalah S, P, D dan F.
Menurut model atom lama Bohr, elektron menempati beberapa tingkat orbit di sekitar nukleus, dari lapisan pertama yang paling dekat dengan nukleus, k, ke lapisan ketujuh, q, yang paling jauh.
Dalam hal model mekanik kuantum yang lebih halus, lapisan K-Q dibagi lagi menjadi satu set orbital, yang masing-masing dapat ditempati oleh tidak lebih dari beberapa elektron.
Umumnya, konfigurasi elektronik digunakan untuk menggambarkan orbital atom dalam keadaan fundamentalnya, tetapi juga dapat digunakan untuk mewakili atom yang telah terionisasi dalam kation atau anion, mengkompensasi dengan kehilangan atau keuntungan elektron di orbital masing -masing.
Banyak sifat fisik dan kimia elemen dapat dikorelasikan dengan konfigurasi elektronik yang unik. Elektron Valencia, elektron di lapisan terluar, adalah faktor penentu untuk kimia unik dari elemen.
Konsep dasar konfigurasi elektronik
Sebelum menetapkan elektron atom ke orbital, seseorang harus terbiasa dengan konsep dasar konfigurasi elektronik. Setiap elemen dari tabel periodik terdiri dari atom, yang terdiri dari proton, neutron dan elektron.
Elektron menunjukkan beban negatif dan berada di sekitar nukleus atom dalam orbital elektron, didefinisikan sebagai volume ruang di mana elektron dapat ditemukan dalam probabilitas 95%.
Empat jenis orbital yang berbeda (S, P, D, dan F) memiliki cara yang berbeda, dan orbital dapat mengandung maksimal dua elektron. Orbital P, D dan F memiliki sub -level yang berbeda, sehingga mereka dapat mengandung lebih banyak elektron.
Dapat melayani Anda: reaktor batch: karakteristik, suku cadang, aplikasiSeperti yang ditunjukkan, konfigurasi elektronik setiap elemen unik untuk posisinya di tabel periodik. Tingkat energi ditentukan oleh periode tersebut, dan jumlah elektron diberikan oleh jumlah atom elemen.
Orbital pada tingkat energi yang berbeda mirip satu sama lain, tetapi menempati area yang berbeda di ruang angkasa.
Orbital 1S dan orbital 2s memiliki karakteristik orbital S (node radio, probabilitas volume bola, hanya dapat mengandung dua elektron, dll.). Tapi, seperti pada tingkat energi yang berbeda, mereka menempati ruang yang berbeda di sekitar nukleus. Setiap orbital dapat diwakili dengan blok spesifik dalam tabel periodik.
Blok S adalah wilayah logam alkali, termasuk helium (kelompok 1 dan 2), blok D adalah logam transisi (kelompok 3 hingga 12), blok P adalah elemen dari kelompok utama kelompok 13 A 18, dan blok F adalah serangkaian lantanida dan aktinid.
Prinsip Aufbau
Aufbau berasal dari kata Jerman Aufbauen, Apa arti "membangun". Intinya, saat menulis konfigurasi elektron, kami membangun orbital elektron saat kami maju dari satu atom ke atom lainnya.
Saat kami menulis konfigurasi elektronik atom, kami akan mengisi orbital dalam meningkatkan urutan nomor atom.
Prinsip Aufbau berasal dari prinsip pengecualian Pauli, yang mengatakan tidak ada dua fermion (misalnya, elektron) dalam atom. Mereka dapat memiliki set kuantum yang sama, jadi mereka harus "menumpuk" pada tingkat energi yang lebih tinggi.
Cara elektron menumpuk adalah masalah konfigurasi elektron.
Atom -atom stabil memiliki elektron sebanyak yang dilakukan proton di dalam nukleus. Elektron bertemu di sekitar nukleus dalam orbital kuantum, mengikuti empat aturan dasar yang disebut prinsip aufbau.
Dapat melayani Anda: barium klorida (BACL2)1. Tidak ada dua elektron dalam atom yang dibagikan oleh empat angka kuantum yang sama n, l, m dan s.
2. Elektron pertama -tama akan menempati orbital tingkat energi terendah.
3. Elektron akan mengisi orbital selalu dengan nomor putaran yang sama. Saat orbital penuh, itu akan dimulai.
4. Elektron akan mengisi orbital untuk jumlah angka kuantum n dan l. Orbital dengan nilai yang sama (n + l) akan diisi terlebih dahulu dengan nilai N yang lebih rendah.
Aturan kedua dan keempat pada dasarnya sama. Contoh aturan empat adalah orbital 2p dan 3s.
Orbital 2p adalah n = 2 dan l = 2 dan orbital 3s adalah n = 3 dan l = 1. (N + l) = 4 dalam kedua kasus, tetapi orbital 2p memiliki energi terendah atau nilai yang lebih rendah dan akan diisi sebelum lapisan 3s.
Untungnya, Anda dapat menggunakan diagram Moeller yang ditunjukkan untuk mengisi elektron. Grafik dibaca dengan mengeksekusi diagonal dari 1s.
 Diagram Moeller. Sumber: Gabriel Bolívar
Diagram Moeller. Sumber: Gabriel Bolívar Sekarang diketahui bahwa urutan orbital diisi, satu -satunya hal yang tersisa adalah menghafal ukuran masing -masing orbital.
Orbital memiliki 1 kemungkinan nilai ml Mengandung 2 elektron
Orbital p memiliki 3 kemungkinan nilai ml Mengandung 6 elektron
Orbital memiliki 5 nilai yang mungkin dari ml Mengandung 10 elektron
F orbital memiliki 7 kemungkinan nilail Mengandung 14 elektron
Hanya ini yang diperlukan untuk menentukan konfigurasi elektronik atom elemen yang stabil.
Misalnya, ambil elemen nitrogen. Nitrogen memiliki tujuh proton dan, oleh karena itu, tujuh elektron. Orbital pertama untuk diisi adalah orbital 1s.
Orbital S memiliki dua elektron, jadi ada lima elektron yang tersisa. Orbital berikutnya adalah orbital 2S dan berisi dua berikutnya. Tiga elektron terakhir akan masuk ke orbital 2p yang dapat mengandung hingga enam elektron.
Dapat melayani Anda: carboxymethylcellulosePentingnya Konfigurasi Elektronik Eksternal
Konfigurasi elektron memainkan peran penting dalam menentukan sifat atom.
Semua atom dari kelompok yang sama memiliki konfigurasi elektronik eksternal yang sama dengan pengecualian angka atom N, itulah sebabnya mereka memiliki sifat kimia yang sama.
Beberapa faktor kunci yang mempengaruhi sifat atom termasuk ukuran orbital terbesar yang ditempati, energi orbital energi terbanyak, jumlah lowongan orbital dan jumlah elektron dalam orbital dengan energi yang lebih besar.
Kebanyakan sifat atom dapat dikaitkan dengan tingkat daya tarik antara elektron di luar nukleus dan jumlah elektron di lapisan elektron terluar, jumlah elektron valensi.
Elektron lapisan luar adalah yang dapat membentuk ikatan kimia kovalen, yang memiliki kemampuan untuk membentuk kation atau anion dan yang memberikan keadaan oksidasi pada elemen kimia.
Mereka juga akan menentukan jari -jari atom. Karena n menjadi lebih besar, jari -jari atom meningkat. Ketika atom kehilangan elektron, akan ada kontraksi jari -jari atom karena penurunan beban negatif di sekitar nukleus.
Elektron lapisan luar diperhitungkan oleh teori tautan Valencia, teori medan kristal dan teori orbital molekuler untuk mendapatkan sifat -sifat molekul dan hibridisasi ikatan.
Referensi
- Aufbau Main. Kimia pulih.Librettexts.org.
- Ilmu Bozeman. Konfigurasi elektron. Pulih dari youtube.com.
- Konfigurasi elektron dan sifat atom. Pulih dari Oneonta.Edu.

