Konstanta Kecepatan

- 2007
- 154
- Tommie Smith
Apa konstanta kecepatannya?
Itu Konstanta Kecepatan Ini adalah konstanta proporsionalitas hukum kecepatan kinetika kimia, yang membentuk hubungan antara konsentrasi molar reagen dan kecepatan reaksi.
Seperti reagen, kecepatan reaksi mengkonsumsi, juga berkurang. Itulah sebabnya dalam perhitungan konstanta kecepatan, diwakili oleh simbol 'K', kecepatan awal diperhitungkan, untuk memiliki titik perbandingan antara beberapa percobaan.

Kinetika kimia menunjukkan bahwa konstanta ini tergantung pada urutan reaksi reagen, yang konsentrasinya akan mengubah kecepatan reaksi. Di sisi lain, menurut persamaan Arrhenius, k juga tergantung pada suhu dan energi aktivasi untuk reaksi.
Itulah sebabnya dikatakan bahwa konstanta kecepatan bukan konstanta yang benar, karena bervariasi dengan suhu dan juga dengan adanya katalis yang memodifikasi energi aktivasi. Oleh karena itu, tidak ada banyak tabel di mana mereka datang untuk reaksi tertentu (dan kondisi).
Misalnya, untuk reaksi di mana A dan B bereaksi, masing -masing dengan urutan reaksi 1, konstanta melaporkan k hingga 25 ° C, dan dengan penambahan sejumlah katalis, itu tidak akan sama jika reaksi dibuat hingga suhu 26 atau 27 ºC. Variasi sekecil apa pun akan mempengaruhi nilai k, yang hanya konstan selama kondisi yang ditetapkan untuk percobaan.
Cara menghitung konstanta kecepatan?
Percobaan
Penentuan nilai konstanta kecepatan reaksi dibuat secara eksperimental. Jika, misalnya, Anda ingin menentukan nilai konstanta kecepatan untuk reaksi formulir:
A +b → c
Untuk pembentukan nilai k, tiga reaksi dapat dibuat, dengan perbedaan berikut: sebagai reaksi 2 konsentrasi awal reagen A adalah konstan, [a], tetapi dua kali lipat, misalnya, konsentrasi reagen B, [ B].
Sementara itu, sebagai reaksi 3 [a] digandakan dibandingkan dengan reaksi 1, menjaga konstan [b].
Dengan demikian, tabel konsentrasi akan dibangun yang akan berfungsi untuk membandingkan kecepatan awal antara beberapa percobaan. Ini dengan tujuan menentukan perintah reaksi, dan secara berurutan untuk menghitung konstanta kecepatan.
Dapat melayani Anda: aluminium hidroksida: struktur, sifat, penggunaan, risikoPerintah reaksi
Perhitungan pertama
Untuk reaksi sebelumnya, kecepatannya diekspresikan oleh persamaan:
Kecepatan reaksi = k · [a]X· [B]Dan
Di mana 'x' e 'dan' sesuai dengan perintah reaksi untuk reagen A dan B, masing -masing.
Untuk menentukan nilai -nilai perintah reaksi, perbandingan antara reaksi 2 dan 1, serta antara reaksi 3 dan 1 harus dibuat.
Saat membandingkan reaksi 1 dengan 2, dapat diamati, misalnya, bahwa dengan menduplikasi [b] ada duplikasi kecepatan reaksi.
Kemudian: proporsi [b] antara reaksi 2 dan 1 adalah 2, serta proporsi antara kecepatan reaksi. Kemudian, nilai urutan reaksi dapat diperoleh sehubungan dengan B (eksponen dan), melalui pendekatan berikut:
 Perhitungan urutan reaksi 'dan'. Sumber: Gabriel Bolívar.
Perhitungan urutan reaksi 'dan'. Sumber: Gabriel Bolívar. Kecepatan percobaan 2 dua kali lebih cepat dari kecepatan percobaan 1. Dengan demikian, membagi dua persamaan di atas yang akan kita miliki:
2 = 2Dan
Oleh karena itu, 'dan' Vale 1, dapat menyimpulkan bahwa urutan reaksi sehubungan dengan reagen B adalah dari urutan pertama.
Perhitungan kedua
Dengan cara yang sama kita melanjutkan dengan reagen A untuk perhitungan 'x':
 Perhitungan urutan reaksi 'x'. Sumber: Gabriel Bolívar.
Perhitungan urutan reaksi 'x'. Sumber: Gabriel Bolívar. Kecepatan percobaan atau reaksi 3 adalah empat kali lebih tinggi dari percobaan atau reaksi 1. Karena itu:
4 = 2X
SALAH SATU
22 = 2X
Dan nilai x adalah 2, jadi reaksi adalah urutan kedua dalam kaitannya dengan reagen.
Kliring terakhir
Kemudian, nilai konstanta kecepatan berdasarkan reaksi mana pun dapat ditetapkan:
Kecepatan reaksi = k · [a]2· [B]
Cukup untuk memperkenalkan nilai -nilai eksperimental dan membersihkan k:
K = kecepatan reaksi / ([a]2· [B])
Contoh
Contoh -contoh berikut berfungsi sebagai pengantar sebelum latihan diselesaikan dari bagian berikut.
Contoh 1
Dalam reaksi kimia:
a) Jika konsentrasi awal reagen menggandakan kecepatan reaksi: apa urutan reaksi sehubungan dengan reagen ini?
b) Jika peningkatan konsentrasi reagen menyebabkan peningkatan kecepatan dalam faktor 8, apa urutan reaksi maka?
c) Jika konsentrasi reagen mengalami perubahan dan kecepatan tetap sama: apa urutan reaksi sehubungan dengan reagen?
Ini dapat melayani Anda: Cycopropane (C3H6)Dalam a) proporsi kecepatan reaksi adalah sama dan proporsi konsentrasi reagen sama dengan 2X,
2 = 2X
Oleh karena itu, x = 1 dan urutan reaksi sehubungan dengan reagen adalah 1.
Dalam b) proporsi kecepatan reaksi adalah 8 (2 (23) dan proporsi konsentrasi reagen sama dengan 2X,
23 = 2X
Oleh karena itu, x = 3 dan urutan reaksi sehubungan dengan reagen adalah 3-
Sementara dalam c) kecepatan reaksi tidak tergantung pada konsentrasi reagen, sehingga urutan reaksi sehubungan dengan reagen adalah nol.
Contoh 2
Reaksinya:
2 tidak2 + SALAH SATU2 → 2 no2
Ini memiliki ekspresi hukum kecepatan berikut:
Kecepatan reaksi = k · [tidak2]2·SALAH SATU2.
Apa urutan reaksi global? Unit apa yang akan k?
Urutan reaksi tentang atau2 Itu adalah 1, dan urutan reaksi sehubungan dengan tidak2 Ini adalah 2, jadi urutan global reaksi adalah jumlah dari nilai -nilai ini, yaitu, 2 + 1 = 3.
Kecepatan reaksi memiliki unit m/s, dan konsentrasi reagen diekspresikan dalam m. Membuat analisis unit yang akan kita miliki:
k = kecepatan reaksi / ([tidak2]2·[SALAH SATU2]
= (M / s) / (m3)
= s-1M-2
Latihan terpecahkan
Latihan 1
Data reaksi berikut diperoleh pada 25 ° C:
A +2 B → C +2 D
Apa ekspresi hukum kecepatan reaksi ini? Berapa nilai konstanta kecepatan Anda?
Perhitungan Perintah Reaksi
Data eksperimental adalah:
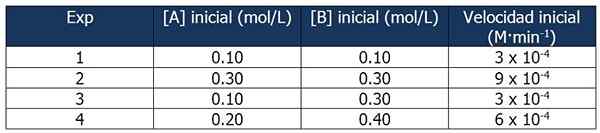 Data Cinetis Latihan 1. Sumber: Gabriel Bolívar.
Data Cinetis Latihan 1. Sumber: Gabriel Bolívar. Perbandingan Eksperimen 1 dan 3 memungkinkan Anda untuk menarik kesimpulan berikut:
Proporsi antara kecepatan reaksi 3 dan 1:
3 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 1
Tetapi proporsi antara konsentrasi B adalah:
(0.3 mol / l) / (0.1 mol/l) = 3
Kecepatan reaksi tidak tergantung pada konsentrasi B, karena peningkatannya tidak mempengaruhinya. Oleh karena itu, urutan reaksi sehubungan dengan reagen B adalah nol.
Di sisi lain, perbandingan reaksi 4 dan 1 memungkinkan kesimpulan berikut:
6 x 10-4 M · min-1 / 3 x 10-4 M · min-1 = 2
Sementara itu, proporsi antara [a] reaksi 4 dan 1 sama dengan:
Dapat melayani Anda: 5 karakteristik campuran homogen(0.20 mol / l) / (0.10 mol/l) = 2X
Maka hubungan antara proporsi adalah:
2 = 2X
x = 1
Oleh karena itu, ekspresi hukum kecepatan adalah:
Kecepatan reaksi = k · [a]
B tidak diambil karena urutan reaksinya adalah nol.
Perhitungan k
Kita dapat menghitung konstanta kecepatan dari salah satu data kinetik. Mari kita gunakan Eksperimen 1:
K = kecepatan reaksi / [a]
= 3 x 10-4 M · min-1 / 0.10 m
= 3 x 10-3 atau 0.003 mnt-1
Latihan 2
Data kecepatan reaksi diperoleh pada suhu tertentu.
2 clo2 (ac) +2 oh- (ac) → clo3- (ac) +clo2 (Ac) +h2Atau (l)
Perhitungan Perintah Reaksi
Data eksperimental adalah:
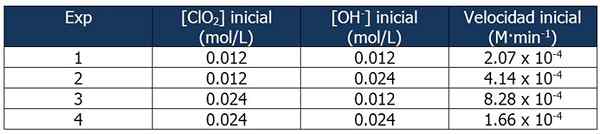 Data Cinetis tentang Latihan 2. Sumber: Gabriel Bolívar.
Data Cinetis tentang Latihan 2. Sumber: Gabriel Bolívar. Proporsi antara kecepatan reaksi 2 dan reaksi 1 adalah:
4.14 x 10-4 M · min-1 / 2.07 x 10-4 M · min-1 = 2
Dan proporsi konsentrasi OH- Antara reaksi 2 dan 1 sama dengan:
(0,024 mol/L)/(0,012 mol/L) = 2X
Eksponen 'x' mewakili urutan reaksi sehubungan dengan reagen OH-. Hubungan antara proporsi yang dihitung dapat direpresentasikan sebagai berikut:
2 = 2X
x = 1
Oleh karena itu, urutan reaksi sehubungan dengan reagen OH- sama dengan 1.
Sebagai reaksi 3 konsentrasi clo berlipat ganda2 reaksi 1, sedangkan konsentrasi OH- Tetap konstan.
Proporsi antara kecepatan reaksi 3 dan 1:
(8.28 x 10-4 M · min-1) / (2.07 x 10-4 M · min-1) = 4 (22)
Dan proporsi [clo2] Antara Reaksi 3 dan 1 sama dengan:
(0,024 mol/L)/(0,012 mol/L) = 2Dan
Eksponen 'dan' mewakili urutan reaksi mengenai reagen CL2.
Membandingkan proporsi:
22 = 2Dan
4 = 2Dan
y = 2
Oleh karena itu, reaksi adalah yang kedua sehubungan dengan reagen CL2.
Ekspresi hukum kecepatan akan menjadi:
Kecepatan reaksi = k · [clo2]2· [Oh-]
Perhitungan k
Sekali lagi, kami dapat menghitung k dari ekspresi sebelumnya menggunakan data kinetik apa pun untuk percobaan. Kami akan menggunakan Eksperimen 3:
K = (8.28 x 10-4 M · min-1) / (0.024 m)2 (0.012 m)
= 119.79 menit-1· M-2
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Laju reaksi konstan. Diperoleh dari: di.Wikipedia.org
- Kimia Texas A&M University. (S.F.). Kinetika: Perhitungan laju sampel. Pulih dari: chem.TAMU.Edu
- Keith J. Laidler. (2020). Laju reaksi. Britannica Encyclopaedia. Dipulihkan dari: Britannica.com
- Helmestine, Anne Marie, PH.D. (25 Agustus 2020). Berapa laju konstan dalam kimia? Pulih dari: thinkco.com
- Clark Jim. (2013). Tingkat konstanta dan persamaan Arrhenius. Pulih dari: chemguide.bersama.Inggris

