Apa hukum bobot kimia? (Contoh)

- 2140
- 177
- Irvin Reichel
Itu Hukum Kehendaman Kimia Mereka adalah yang telah menunjukkan bahwa massa zat yang bereaksi tidak melakukannya secara sewenang -wenang atau acak; tetapi mempertahankan proporsi matematika konstan dari bilangan bulat atau submultiple dari mereka, di mana atom -atom unsur tidak dibuat atau dihancurkan.
Di masa lalu menetapkan undang -undang ini membutuhkan upaya penalaran yang luar biasa; Karena meskipun sekarang tampaknya terlalu jelas, sebelum massa atom atau molekul dari unsur atau senyawa bahkan tidak diketahui, masing -masing.
 Sumber: Jeff Keyzer dari Austin, TX, USA [CC BY-SA 2.0 (https: // createveCommons.Org/lisensi/by-sa/2.0)]
Sumber: Jeff Keyzer dari Austin, TX, USA [CC BY-SA 2.0 (https: // createveCommons.Org/lisensi/by-sa/2.0)] Karena tidak diketahui bagaimana tepatnya mol atom dari masing -masing elemen setara, bahan kimia abad kedelapan belas dan kesembilan belas harus didasarkan pada massa yang bereaksi. Sehingga skala analitik yang belum sempurna (gambar superior) adalah teman yang tidak terpisahkan selama ratusan percobaan yang diperlukan untuk penyelesaian undang -undang pembobotan.
Karena alasan inilah ketika hukum kimia ini dipelajari, mereka menemukan pengukuran massa setiap saat. Berkat ini, mengekstrapolasi hasil percobaan, ditemukan bahwa senyawa kimia Murni Mereka selalu terbentuk dengan proporsi massa yang sama dari elemen konstituen mereka.
[TOC]
Hukum Konservasi Misa
Undang -undang ini mengatakan bahwa dalam reaksi kimia, massa total reagen sama dengan massa total produk; Selama sistem dipertimbangkan ditutup dan tidak ada pertukaran massa dan energi dengan lingkungannya.
Dalam reaksi kimia, zat tidak hilang, tetapi diubah menjadi zat lain dengan massa yang sama; Dari sana frasa terkenal: "Tidak ada yang diciptakan, tidak ada yang dihancurkan, semuanya diubah".
Secara historis, hukum konservasi massa dalam reaksi kimia pertama kali diusulkan pada 1756 oleh Mikhail Lomonsov, yang menunjukkan dalam buku hariannya hasil eksperimennya.
Selanjutnya pada 1774, Antoine Levoisier, seorang ahli kimia Prancis, mempresentasikan hasil eksperimennya yang memungkinkan untuk menetapkan ini; Yang, beberapa juga menyebutnya Hukum Lavoisier.
-Eksperimen Lavoisier
Pada masa Lavoisier (1743-1794), ada teori Flogisto, yang menurutnya tubuh memiliki kemampuan untuk mengobarkan atau membakar. Eksperimen Lavoisier diizinkan untuk membuang teori ini.
Lavoisier melakukan banyak percobaan pembakaran logam. Dia dengan hati -hati menimbang bahan sebelum dan sesudah pembakarannya dalam wadah tertutup, menemukan bahwa ada penambahan berat badan yang jelas.
Tetapi Lavoiser, berdasarkan pengetahuan tentang peran oksigen dalam pembakaran, menyimpulkan bahwa kenaikan berat badan dalam pembakaran adalah karena penggabungan oksigen ke dalam bahan pembakaran. Konsep logam oksida lahir.
Oleh karena itu, jumlah massa logam yang mengalami pembakaran dan oksigen tetap tidak dapat diubah. Kesimpulan ini memungkinkan pembentukan undang -undang konservasi massal.
-Menyeimbangkan persamaan
Undang -undang Konservasi Massal menetapkan kebutuhan untuk menyeimbangkan persamaan kimia, menjamin bahwa jumlah semua elemen yang terlibat dalam reaksi kimia, serta reagen atau produk, persis sama.
Ini adalah persyaratan penting untuk keakuratan perhitungan stoikiometri yang dibuat.
-Perhitungan
Mol air
Berapa banyak mol air yang dapat terjadi selama pembakaran 5 mol metana dalam oksigen berlebih? Juga menunjukkan bahwa hukum konservasi materi terpenuhi.
Ch4 + 2 o2 => Co2 + 2 h2SALAH SATU
Mengamati persamaan reaksi yang seimbang, disimpulkan bahwa 1 mol metana menghasilkan 2 mol air.
Masalahnya dapat diselesaikan secara langsung dengan pendekatan sederhana, karena kami tidak memiliki 1 mol tetapi 5 mol cho4:
Mol air = 5 mol cho4· (2 mol H2O / 1 mol cho4)
= 10
Apa yang setara dengan 180 g h2SALAH SATU. 5 mol atau 220 g CO juga terbentuk2, yang sama dengan massa total 400 g produk.
Dengan demikian, untuk hukum konservasi subjek bereaksi 400 g reagen; tidak lebih, tidak kurang. Dari 400 g, 80 g sesuai dengan 5 mol cho4 (Mengalikan dengan massa molekulnya 16 g/mol), dan 320 g pada 10 mol O2 (Demikian pula karena massa molekulnya 32 g/mol).
Pembakaran pita magnesium
Tape magnesium 1,50 g dibakar dalam wadah tertutup yang mengandung 0,80 g oksigen. Setelah pembakaran, 0,25 g oksigen ada di dalam wadah. a) Apa yang bereaksi massa oksigen? b) Berapa banyak magnesium oksida terbentuk?
Dapat melayani Anda: Solusi Hipotonik: Komponen, Persiapan, ContohMassa oksigen yang bereaksi diperoleh dengan perbedaan sederhana.
Oxygen Oxygen Consumed = (massa awal - massa residu) oksigen
= 0,80 g - 0,25 g
= 0,55 g atau2 (ke)
Menurut undang -undang konservasi massal,
Massa magnesium oksida = massa magnesium +massa oksigen
= 1,50 g + 0,55 g
= 2.05 g mgo (b)
Hukum proporsi yang pasti
Joseph Louis Proust (1754-1826), ahli kimia Prancis, menyadari bahwa dalam reaksi kimia elemen kimia selalu bereaksi dalam proporsi massa tetap untuk membentuk senyawa murni spesifik; Oleh karena itu, komposisinya konstan, terlepas dari sumber atau asal, atau bagaimana itu disintesis.
Proust pada 1799 menyatakan hukum proporsi yang ditentukan, yang menyatakan bahwa: "Ketika dua atau lebih elemen digabungkan untuk membentuk senyawa, mereka melakukannya dalam hubungan massa yang tetap". Jadi, hubungan ini diperbaiki dan tidak bergantung pada strategi yang diikuti untuk persiapan senyawa.
Hukum ini juga dikenal sebagai Hukum Komposisi Konstan, yang menyatakan bahwa: "Setiap senyawa kimia dalam kemurnian selalu mengandung unsur -unsur yang sama, dalam proporsi massa yang konstan".
-Ilustrasi Hukum
Besi (iman) bereaksi dengan sulfur (S) untuk membentuk besi sulfida (FES), tiga situasi dapat diindikasikan (1, 2 dan 3):
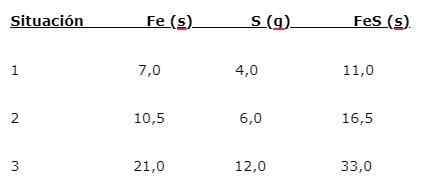
Untuk menemukan proporsi di mana unsur -unsur digabungkan, massa utama (iman) dibagi dengan massa minor. Perhitungan memberikan proporsi 1,75: 1. Nilai ini diulang dalam tiga kondisi yang diberikan (1, 2 dan 3), di mana proporsi yang sama diperoleh meskipun massa yang berbeda digunakan.
Artinya 1,75 g iman dikombinasikan dengan 1,0 g S untuk memberikan 2,75 g fes.
-Aplikasi
Melalui aplikasi hukum ini, Anda dapat mengetahui dengan tepat massa elemen yang harus digabungkan untuk mendapatkan massa senyawa yang diinginkan.
Dengan cara ini, informasi tentang massa sisa dari salah satu elemen yang terlibat dalam reaksi kimia dapat diperoleh, atau jika ada reagen pembatas dalam reaksi.
Selain itu, berlaku untuk mengetahui komposisi senyawa senyawa, dan berdasarkan yang terakhir, rumus senyawa dapat ditetapkan.
Komposisi senyawa senyawa
Karbon dioksida (CO2) terbentuk dalam reaksi berikut:
C +o2 => Co2
12 g karbon 32 g oksigen digabungkan untuk memberikan 44 g karbon dioksida.
Jadi, persentase karbon sama dengan
Persentase karbon = (12 g / 44 g) · 100 %
= 27,3 %
Persentase oksigen = (32 g / 44 g) · 100 %
Persentase oksigen = 72,7 %
Menggunakan pernyataan hukum komposisi konstan, dapat dicatat bahwa karbon dioksida selalu dibentuk oleh 27,3 % karbon dan 72,7 % oksigen.
-Perhitungan
Sulfur trioksida
Dengan bereaksi dalam wadah yang berbeda 4 g dan 6 g belerang (S) dengan oksigen (O), masing -masing diperoleh, masing -masing, 10 g dan 15 g sulfur trioksida (SO3).
Mengapa jumlah sulfur trioksida dan bukan yang lain?
Juga hitung jumlah sulfur yang diperlukan untuk digabungkan dengan 36 g oksigen dan adonan sulfur trioksida yang diperoleh.
Bagian A)
Dalam wadah pertama, 4 g g g oksigen dicampur untuk mendapatkan 10 g trioksida. Jika hukum konservasi massa diterapkan, kita dapat membersihkan massa oksigen yang dikombinasikan dengan belerang.
Massa oksigen = 10 g oksigen trioksida - 4 g belerang.
= 6 g
Dalam wadah 2 6 g belerang dicampur dengan x g oksigen untuk mendapatkan 15 sulfur trioksida.
Massa oksigen = 15 g sulfur trioksida - 6 g belerang
= 9 g
Proporsi O/S untuk setiap wadah kemudian dihitung:
Proporsi o / s dalam situasi 1 = 6 g o / 4 g s
= 1.5 / 1
Proporsi o / s dalam situasi 2 = 9 g o / 6 g s
= 1.5 / 1
Yang, setuju dengan apa yang diangkat dalam hukum proporsi yang ditentukan menunjukkan bahwa elemen selalu digabungkan dalam proporsi yang sama untuk membentuk senyawa tertentu.
Oleh karena itu, nilai yang diperoleh benar dan yang sesuai dengan penerapan hukum.
Bagian B)
Pada bagian sebelumnya nilai 1,5 / 1 dihitung untuk proporsi o / s.
Dapat melayani Anda: keadaan agregasi materiG sulfur = 36 oksigen · (1 g sulfur / 1,5 g oksigen)
= 24 g
G sulfur trioksida = 36 g oksigen + 24 g belerang
= 60 g
Klorin dan magnesium
Klorin dan magnesium digabungkan dalam proporsi 2,95 g klorin untuk setiap g magnesium. a) Tentukan massa klorin dan magnesium yang diperlukan untuk mendapatkan 25 g magnesium klorida. b) Berapa persentase komposisi magnesium klorida?
Bagian A)
Berdasarkan nilai 2.95 untuk rasio CL: MG, pendekatan berikut dapat dibuat:
2.95 g Cl +1 g Mg => 3,95 g MGCL2
Kemudian:
g cl = 25 g mgcl2 · (2.95 g CL / 3.95 G MGCL2)
= 18.67
G mg = 25 g mgcl2 · (1 g mg / 3,95 g mgcl2)
= 6.33
Kemudian, 18,67 g klorin dikombinasikan dengan 6,33 g magnesium untuk menghasilkan 25 g magnesium klorida.
Bagian B)
Massa molekul magnesium klorida, MGCL dihitung terlebih dahulu2:
Berat molekul mgcl2 = 24.3 g/mol + (2 · 35.5 g/mol)
= 95.3 g/mol
Persentase magnesium = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Persentase klorin = (71 g / 95,3 g) x 100 %
= 74,5 %
Hukum banyak proporsi atau hukum Dalton
Undang -undang tersebut dinyatakan pada tahun 1803 oleh ahli kimia dan ahli meteorologi Prancis John Dalton, berdasarkan pengamatannya mengenai reaksi gas atmosfer.
Undang -undang dinyatakan sebagai berikut: "Ketika elemen digabungkan untuk memberikan lebih dari satu senyawa, massa variabel salah satunya bergabung dengan massa tetap yang lain dan yang pertama memiliki hubungan kanon dan angka tidak jelas".
Juga: "Ketika dua elemen digabungkan untuk menyebabkan senyawa yang berbeda, diberi jumlah tetap dari salah satunya, jumlah yang berbeda dari elemen lain yang dikombinasikan dengan jumlah tetap untuk menghasilkan senyawa, berhubungan dengan bilangan bulat sederhana".
John Dalton membuat deskripsi modern pertama dari atom sebagai komponen elemen kimia, ketika ia menunjukkan bahwa elemen -elemen tersebut dibentuk oleh partikel -partikel yang tidak terpisahkan yang disebut atom.
Selain itu, ia mendalilkan bahwa senyawa terbentuk ketika atom dari berbagai elemen bergabung satu sama lain dalam proporsi bilangan bulat sederhana.
Dalton menyelesaikan pekerjaan penelitian Proust. Dia menunjukkan keberadaan dua oksida timah, dengan persentase 88,1% dan 78,7% timah dengan persentase oksigen yang sesuai, masing -masing 11,9% dan 21,3%.
-Perhitungan
Air dan hidrogen peroksida
Tunjukkan senyawa air itu, h2Atau, dan hidrogen peroksida, h2SALAH SATU2, Mereka mematuhi hukum proporsi berganda.
Berat atom elemen: h = 1 g/mol dan oksigen = 16 g/mol.
Peso molekul senyawa: h2O = 18 g/mol dan h2SALAH SATU2 = 34 g/mol.
Hidrogen adalah elemen dengan jumlah tetap di h2Atau dan h2SALAH SATU2, Jadi proporsi antara O dan H akan ditetapkan di kedua senyawa.
Rasio o/h di h2O = (16 g/mol)/(2 g/mol)
= 8/1
Rasio o/h di h2SALAH SATU2 = (32 g/mol)/(2 g/mol)
= 16/1
Hubungan antara kedua proporsi = (16/1)/(8/1)
= 2
Kemudian, rasio OR/H antara hidrogen peroksida dan air adalah 2, bilangan bulat dan bilangan sederhana. Ada kepatuhan yang ditunjukkan dengan hukum proporsi berganda.
Nitrogen oksida
Massa oksigen apa yang dikombinasikan dengan 3,0 g nitrogen dalam a) nitrat oksida, NO dan B) nitrogen dioksida, NO2. Tunjukkan bahwa tidak dan tidak2 Mereka mematuhi hukum proporsi berganda.
Massa nitrogen = 3 g
Berat atom: nitrogen, 14 g/mol, dan oksigen, 16 g/mol.
Perhitungan
Dalam NO, atom N dikombinasikan dengan 1 atom O, sehingga massa oksigen yang dikombinasikan dengan 3 g nitrogen dapat dihitung dengan pendekatan berikut:
G nitrogen O = G. O / pa. N)
= 3 g · (16 g/mol/14 g/mol)
= 3.43 g atau
Di no2, Atom N dikombinasikan dengan 2 atom O, sehingga massa oksigen yang digabungkan adalah:
g oksigen = 3 g · (32 g/mol/14 g/mol)
= 6.86 g atau
Proporsi o/ n pada NO = 3,43 g o/ 3 g n
= 1.143
Proporsi atau/n di no2 = 6.86 g o / 3 g n
= 2.282
Nilai hubungan antara proporsi O / N = 2.282 / 1.143
= 2
Kemudian, nilai hubungan antara proporsi atau/n adalah 2, bilangan bulat dan angka sederhana. Oleh karena itu, hukum proporsi berganda terpenuhi.
Hukum proporsi timbal balik
Undang -undang ini diformulasikan oleh Richter dan Carl f. Wenzel terpisah.
Dapat melayani Anda: Sodium: Sejarah, Struktur, Sifat, Risiko dan PenggunaanMisalnya, jika Anda memiliki dua senyawa AB dan CB, diamati bahwa elemen umum adalah B.
Hukum Richter-Wenzel atau proporsi timbal balik mengatakan bahwa, mengetahui seberapa banyak A bereaksi dengan B untuk memberikan AB, dan seberapa banyak C bereaksi dengan B untuk memberikan CB, Anda dapat menghitung massa yang diperlukan untuk bereaksi dengan massa C terhadap C ke untuk untuk Mac.
Dan hasilnya adalah proporsi dari: C atau A/C harus berupa ganda atau submultiple dari A/B atau C/B. Namun, undang -undang ini tidak selalu terpenuhi, terutama ketika elemen -elemen tersebut menyajikan beberapa keadaan oksidasi.
Dari semua undang -undang berat ini mungkin yang paling "abstrak" atau rumit. Tetapi jika dianalisis dari sudut pandang matematika, itu akan dilihat yang hanya terdiri dari faktor konversi dan pembatalan.
-Contoh
Metana
Jika diketahui bahwa 12 g karbon bereaksi dengan 32 g oksigen untuk membentuk karbon dioksida; dan bahwa, di sisi lain, 2 g hidrogen bereaksi dengan 16 g oksigen untuk membentuk air, kemudian proporsi massa C/O dan H/atau untuk CO dapat diperkirakan2 dan H2Atau, masing -masing.
Menghitung C/O dan H/atau Anda memiliki:
C / o = 12g c / 32g atau
= 3/8
H / o = 2g h / 16g atau
= 1/8
Oksigen adalah elemen umum, dan diinginkan untuk mengetahui berapa banyak karbon yang bereaksi dengan hidrogen untuk menghasilkan metana; Yaitu, Anda ingin menghitung C/H (atau H/C). Kemudian, perlu membuat pembagian dari proporsi sebelumnya untuk menunjukkan apakah timbal balik terpenuhi atau tidak:
C/h = (c/o)/(h/o)
Perhatikan bahwa dengan cara ini OS dibatalkan dan C/H tetap:
C/H = (3/8)/(1/8)
= 3
Dan 3 adalah 3/8 multipel (3/8 x 8). Ini berarti bahwa 3 g C bereaksi dengan 1 g H untuk memberikan metana. Tapi, untuk dapat membandingkannya dengan CO2, Dikalikan C/H dengan 4, yang sama dengan 12; Ini memberi 12 g C yang bereaksi dengan 4 g H untuk membentuk metana, yang juga benar.
Magnesium sulfida
Jika diketahui bahwa 24 g magnesium bereaksi dengan 2 g hidrogen untuk membentuk magnesium hidrida; Dan selain itu, 32 g sulfur bereaksi dengan 2 g hidrogen untuk membentuk hidrogen sulfida, elemen yang sama adalah hidrogen dan ingin menghitung mg/s dari mg/jam dan h/s.
Kemudian menghitung mg/jam dan h/s secara terpisah Anda memiliki:
Mg / jam = 24g mg / 2g h
= 12
H / s = 2g h / 32g s
= 1/16
Namun, lebih mudah menggunakan S/H untuk membatalkan h. Oleh karena itu, S/H sama dengan 16. Selesai ini, kami melanjutkan untuk menghitung mg/s:
Mg/s = (mg/jam)/(s/jam)
= (12/16)
= 3/4
Dan 3/4 adalah submultiple 12 (3/4 x 16). Proporsi mg/s menunjukkan bahwa 3 g mg bereaksi dengan 4 g belerang untuk membentuk magnesium sulfida. Namun, Anda harus mengalikan mg/s dengan 8 untuk dapat membandingkannya dengan mg/jam. Dengan demikian, 24 g Mg bereaksi dengan 32 g belerang untuk memberikan logam sulfida ini.
Aluminium klorida
Diketahui bahwa 35,5 g CL bereaksi dengan 1 g H untuk membentuk HCl. Juga, 27 g AL bereaksi dengan 3 g H untuk membentuk ALH3. Hitung proporsi aluminium klorida dan katakan jika senyawa semacam itu mematuhi hukum Richter-Wenzel.
Sekali lagi, Cl/H dan AT/H dihitung secara terpisah:
Cl / h = 35.5g cl / 1g h
= 35.5
At/ h = 27g at/ 3g h
= 9
Sekarang, dihitung ke/cl:
At/cl = (al/h)/(cl/h)
= 9/35.5
≈ 0,250 atau 1/4 (sebenarnya 0,253)
Yaitu, 0,250 g Al bereaksi dengan 1 g CL untuk membentuk garam yang sesuai. Tapi, sekali lagi, itu harus dikalikan ke/cl dengan angka yang memungkinkan membandingkannya (untuk kenyamanan) dengan AL/H.
Ketidaksopanan dalam perhitungan
Kemudian dikalikan AT/CL dengan 108 (0,27/250), memberikan 27 g di antaranya bereaksi dengan 108 g CL. Ini tidak terjadi dengan tepat. Jika kita mengambil misalnya nilai 0,253 dengan AL/CL, dan kita melipatgandakannya dengan 106,7 (27/0,253), 27 g Al bereaksi dengan 106,7 g CL; Yang, lebih mendekati kenyataan (ALCL3, dengan PA 35,5 g/mol untuk CL).
Di sini diamati bagaimana hukum Richter dapat mulai kokoh karena presisi dan penyalahgunaan desimal.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Bunga, J. Kimia (2002). Editorial Santillana.
- Joaquín San Frutos Fernández. (S.F.). Hukum berat dan volumetrik. Pulih dari: encina.pntic.MEC.adalah
- Toppr. (S.F.). Hukum Kombinasi Kimia. Pulih dari: toppr.com
- Cemerlang. (2019). Hukum Kombinasi Kimia. Pulih dari: brilian.org
- Libretteks Kimia. (15 Juli 2015). Hukum Kimia Dasar. Pulih dari: chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (18 Januari 2019). Hukum Konservasi Misa. Pulih dari: thinkco.com
- « Penaklukan penemuan, tahapan, konsekuensi Kolombia
- 9 Output kerja dari karier Administrasi Bisnis »

