Denaturasi protein apa, faktor, konsekuensi
- 3330
- 207
- Frederick Pfeffer
Apa denaturasi protein?
Itu Denaturasi protein Ini terdiri dari hilangnya struktur tiga dimensi karena berbagai faktor lingkungan, seperti suhu, pH atau agen kimia tertentu. Hilangnya struktur mengakibatkan hilangnya fungsi biologis yang terkait dengan protein itu, baik enzimatik, struktural, transporter, antara lain.
Struktur protein sangat sensitif terhadap perubahan. Destabilisasi jembatan hidrogen esensial tunggal dapat mendenaturalisasi protein. Dengan cara yang sama, ada interaksi yang tidak sepenuhnya penting untuk memenuhi fungsi protein, dan, dalam hal menjadi tidak stabil, ia tidak berpengaruh pada operasi.
Struktur protein
Untuk memahami proses denaturasi protein, kita harus tahu bagaimana protein diatur. Ini memiliki struktur primer, sekunder, tersier dan kuaterner.
Struktur utama
Ini adalah urutan asam amino yang membentuk protein ini. Asam amino adalah blok dasar yang membentuk biomolekul ini dan ada 20 jenis yang berbeda, masing -masing dengan sifat fisik dan kimia tertentu. Mereka bergabung bersama melalui tautan peptida.
Struktur sekunder
Dalam struktur ini rantai linier asam amino ini mulai dilipat oleh jembatan hidrogen. Ada dua struktur sekunder dasar: baling -baling α, berbentuk spiral; dan β daun lipat, ketika dua rantai linier disejajarkan secara paralel.
Struktur tersier
Ini melibatkan jenis kekuatan lain yang menghasilkan lipatan spesifik dari bentuk tiga dimensi.
Rantai R residu asam amino yang membentuk struktur protein dapat membentuk jembatan disulfida dan bagian hidrofobik dari protein dikelompokkan di dalam, sedangkan hidrofilikas menghadap air ke air. Pasukan Van der Waals bertindak sebagai penstabil interaksi yang dijelaskan.
Dapat melayani Anda: isoleucine: karakteristik, fungsi, biosintesis, makananStruktur Kuarter
Itu terdiri dari agregat unit protein.
Ketika protein didenaturasi, ia kehilangan struktur kuaterner, tersier dan sekunder, sedangkan primer tetap utuh. Protein yang kaya akan hubungan disulfida (struktur tersier) memberikan resistensi denaturasi yang lebih besar.
Faktor yang menyebabkan denaturasi
Faktor apa pun yang mengacaukan ikatan non -kovalen yang bertanggung jawab untuk mempertahankan struktur asli protein dapat menghasilkan denaturasinya. Di antara yang paling penting yang bisa kita sebutkan:
ph
Pada nilai pH yang sangat ekstrem, baik sarana asam atau basa, protein dapat kehilangan konfigurasi tiga dimensi. Kelebihan Hones H+ dan oh- Di tengah interaksi protein yang tidak stabil.
Perubahan pola ion ini menghasilkan denaturasi. Denaturasi pH dapat dibalik dalam beberapa kasus, dan di lain yang tidak dapat diubah.
Suhu
Denaturasi termal terjadi dengan meningkatkan suhu. Dalam organisme yang hidup dalam kondisi lingkungan rata -rata, protein mulai mengacaukan pada suhu yang lebih besar dari 40 ° C. Jelas, protein organisme termofilik dapat mendukung rentang suhu ini.
Peningkatan suhu diterjemahkan ke dalam peningkatan gerakan molekuler yang mempengaruhi jembatan hidrogen dan ikatan non -kovalen lainnya, yang mengakibatkan hilangnya struktur tersier.
Suhu ini meningkat menyebabkan kecepatan reaksi, jika kita berbicara tentang enzim.
Zat kimia
Zat kutub - seperti urea - dalam konsentrasi tinggi mempengaruhi jembatan hidrogen. Demikian juga, zat non -plolar dapat memiliki konsekuensi yang sama.
Deterjen juga dapat mengacaukan struktur protein; Namun, ini bukan proses yang agresif dan sebagian besar reversibel.
Dapat melayani Anda: Kecoa Jerman: Karakteristik, reproduksi, makananAgen pereduksi
Β-mercaptoetanol (Hoch2ch2sh) adalah agen kimia yang sering digunakan di laboratorium untuk mendenaturalisasi protein. Itu bertanggung jawab untuk mengurangi jembatan disulfida antara limbah asam amino. Dapat mengacaukan struktur protein tersier atau kuaterner.
Agen pereduksi lain dengan fungsi yang serupa adalah Ditiotreitol (DTT). Selain itu, faktor -faktor lain yang berkontribusi pada hilangnya struktur asli dalam protein adalah logam berat dalam konsentrasi tinggi dan radiasi ultraviolet.
Konsekuensi dari Denaturasi protein
Ketika denaturalisasi terjadi, protein kehilangan fungsinya. Protein bekerja secara optimal ketika mereka berada dalam keadaan asli mereka.
Hilangnya fungsi tidak selalu dikaitkan dengan proses denaturasi. Perubahan kecil dalam struktur protein dapat menyebabkan hilangnya fungsi tanpa mengacaukan seluruh struktur tiga dimensi.
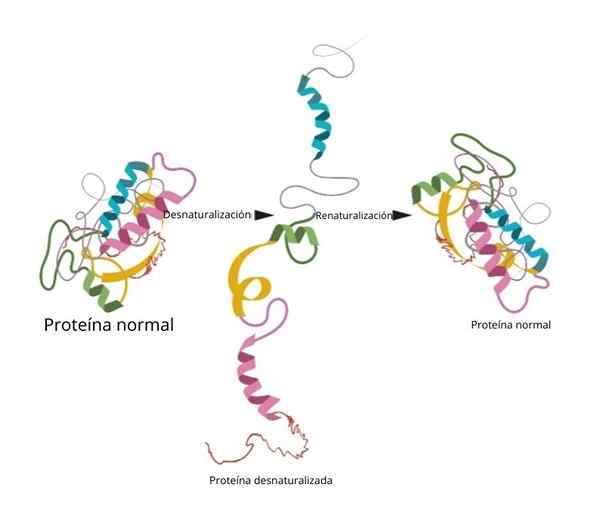
Prosesnya mungkin atau mungkin tidak dapat diubah. Di laboratorium, jika kondisinya terbalik bahwa protein kembali ke konfigurasi awalnya.
Renaturalisasi
Salah satu eksperimen paling terkenal dan konklusif tentang renaturalisasi dibuktikan di ribonuklease.
Ketika para peneliti menambahkan agen denaturasi seperti urea atau β-mercaptanol, protein didenaturasi. Jika agen -agen ini dihilangkan, protein kembali ke konformasi asli mereka dan dapat melakukan fungsinya dengan efisiensi 100 %.
Salah satu kesimpulan terpenting dari penelitian ini adalah untuk secara eksperimental menunjukkan bahwa konformasi tiga -dimensi protein diberikan oleh struktur utamanya.
Dalam beberapa kasus, proses denaturalisasi benar -benar tidak dapat diubah. Misalnya, ketika kami memasak telur, kami menerapkan panas dalam protein (yang utama adalah albumin) yang membentuknya, jernih mengambil penampilan yang solid dan keputihan. Secara intuitif dapat menyimpulkan bahwa, meskipun kami mendinginkannya, ia tidak akan kembali ke bentuk awalnya.
Dapat melayani Anda: ovogenesis: fase, karakteristik pada hewan dan tumbuhanDalam kebanyakan kasus, proses denaturalisasi disertai dengan kehilangan kelarutan. Viskositas, kecepatan difusi juga berkurang dan mengkristal lebih mudah.
Protein chaperonas
Protein chaperonas atau chaperonin bertanggung jawab untuk mencegah denaturasi protein lainnya. Mereka juga menekan interaksi tertentu yang tidak memadai di antara protein untuk memastikan lipatan yang benar dari mereka.
Saat suhu sedang meningkat, protein ini meningkatkan konsentrasi dan bertindak dengan mencegah denaturasi protein lainnya. Inilah sebabnya mengapa mereka juga disebut "protein kejut termal" atau HSP untuk akronimnya dalam bahasa Inggris (Panas protein kejut).
Chaperonin analog dengan kandang atau barel yang melindungi protein yang menarik di dalamnya.
Protein yang merespons situasi stres seluler ini telah dilaporkan dalam berbagai kelompok organisme hidup dan sangat terpelihara. Ada berbagai jenis pendamping dan diklasifikasikan sesuai dengan berat molekulnya.

