Struktur karbon disulfida (CS2), sifat, penggunaan, risiko
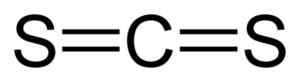
- 2524
- 306
- Jessie Harvey
Dia karbon disulfida Ini adalah senyawa yang dibentuk oleh penyatuan atom karbon (C) dan dua atom belerang (s). Formula kimianya adalah CS2. Ini adalah cairan yang tidak berwarna atau sedikit kuning dengan aroma yang tidak menyenangkan karena kotoran yang dikandungnya (senyawa belerang). Saat murni baunya lembut dan manis, mirip dengan kloroform atau eter.
Secara alami berasal dari aksi sinar matahari pada molekul organik yang ditemukan di air laut. Selain itu, itu terjadi di perairan rawa dan juga dikeluarkan dari gunung berapi bersama dengan gas lainnya.
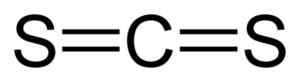 CS karbon disulfida2. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
CS karbon disulfida2. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Karbon disulfida adalah cairan yang mudah menguap dan juga sangat mudah terbakar, sehingga harus dijauhkan dari api dan percikan api atau perangkat yang dapat memproduksinya, termasuk umbi listrik.
Ini memiliki kemampuan untuk melarutkan sejumlah besar senyawa, bahan dan elemen, seperti fosfor, sulfur, selenium, resin, pernis, dll. Oleh karena itu ia menemukan utilitas sebagai pelarut.
Ini juga perantara dalam berbagai reaksi kimia industri, seperti produksi rayon atau sutra buatan.
Itu harus dimanipulasi dengan hati -hati dan dengan alat perlindungan karena sangat beracun dan berbahaya.
[TOC]
Struktur
Karbon disulfida memiliki atom karbon dan dua atom belerang di sisi ini.
Hubungan antara atom karbon dan atom belerang kovalen dan ganda, oleh karena itu mereka sangat kuat. Molekul CS2 Ini memiliki struktur linier dan simetris.
 Struktur linier karbon disulfida CS2. Hitam = karbon, kuning = belerang. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons.
Struktur linier karbon disulfida CS2. Hitam = karbon, kuning = belerang. Penulis: Benjah-BMM27. Sumber: Wikimedia Commons. Tata nama
- Karbon disulfida
- Karbon bisulfida
- Ditiocarbonic anhydride
Properti
Keadaan fisik
Tidak berwarna hingga kekuningan.
Berat molekul
76.15 g/mol
Titik fusi atau solidifikasi
-110.8 ° C
Titik didih
46.0 ºC
Titik nyala
-30 ºC (metode cangkir tertutup).
Suhu self -rection
90 ° C
Kepadatan
Cairan = 1,26 g/cm3 pada 20 ºC.
Uap = 2,67 kali udara.
Uapnya lebih dari ganda berat dari udara dan cairan lebih berat dari air.
Tekanan uap
279 mmHg pada 25 ° C.
Dapat melayani Anda: kalium hipoklorit (kclo)Ini adalah tekanan uap yang tinggi.
Kelarutan
Sangat sedikit air larut: 2,16 g/l a 25 ° C. Larut dalam kloroform. Lembar dengan etanol, metanol, eter, benzena, kloroform dan karbon tetrachloride.
Sifat kimia
CS2 Ini menguap dengan mudah pada suhu kamar karena titik didihnya sangat rendah dan tekanan uapnya sangat tinggi.
Karbon disulfida sangat mudah terbakar. Uapnya sangat mudah meradang, bahkan dengan panasnya bola lampu listrik. Ini berarti bereaksi dengan oksigen dengan sangat cepat:
CS2 + 3 o2 → co2 + 2 Jadi2
Fakta bahwa Anda memiliki tekanan uap tinggi pada suhu kamar membuatnya berbahaya dekat dengan api.
Saat dipanaskan hingga dekomposisi dapat dengan mudah dieksploitasi, memancarkan gas beracun dari sulfur oksida. Di atas 90 ° C dihidupkan secara spontan.
Itu rusak saat disimpan untuk waktu yang lama. Serang tembaga dan paduannya. Itu juga bereaksi dengan beberapa plastik, karet dan lapisan.
Bereaksi dalam kondisi tertentu dengan air, membentuk OCS karbonil sulfida, batubara dioksida Co2 dan hidrogen disulfida h2S:
CS2 + H2O → ocs + h2S
CS2 + 2 h2O → co2 + 2 h2S
Dengan alkohol (ROH) dalam medium alkali membentuk xantat (RO-CS-NNA):
CS2 + ROH + NaOH → H2Atau + ro -c (= s) -sna
Memperoleh
Karbon disulfida disiapkan secara komersial dengan reaksi belerang dengan batubara. Proses ini dilakukan pada suhu 750-900 ° C.
C + 2 S → CS2
Alih-alih batubara Anda juga dapat menggunakan metana atau gas alam, dan bahkan etana, propana dan propilena telah digunakan, dalam hal ini reaksi terjadi pada 400-700 ° C dengan kinerja tinggi.
Itu juga dapat disiapkan dengan bereaksi gas alam dengan hidrogen sulfida h2S Suhu yang sangat tinggi.
Kehadiran di alam
CS2 Ini adalah produk alami yang ada di atmosfer dalam jumlah yang sangat kecil (jejak). Itu terjadi secara fotokimia di perairan permukaan.
Tindakan sinar matahari pada senyawa tertentu yang ada di air laut seperti sistein (asam amino) menyebabkan pembentukan karbon disulfida karbon.
 Karbon disulfida dapat dibentuk dengan aksi sinar matahari pada beberapa senyawa organik yang ada di air laut. Penulis: Pexels. Sumber: Pixabay.
Karbon disulfida dapat dibentuk dengan aksi sinar matahari pada beberapa senyawa organik yang ada di air laut. Penulis: Pexels. Sumber: Pixabay. Ini juga secara alami dilepaskan selama letusan gunung berapi dan ditemukan dalam jumlah kecil di atas rawa -rawa.
Dapat melayani Anda: benzaldehydeBiasanya kami terpapar bernafas dalam proporsi yang sangat kecil dan hadir dalam beberapa makanan. Itu juga ditemukan dalam asap rokok.
Di lingkungan itu terurai melalui sinar matahari. Di tanah itu bergerak melaluinya. Beberapa mikroorganisme tanah rusak.
Aplikasi
Di industri kimia
Karbon disulfida adalah senyawa kimia yang penting karena berfungsi untuk menyiapkan bahan kimia lainnya. Dapat bertindak sebagai perantara kimia.
Ini juga digunakan sebagai pelarut proses misalnya untuk melarutkan fosfor, sulfur, selenium, bromin, yodium, lemak, resin, lilin, pernis dan karet.
Memungkinkan pembuatan produk farmasi dan herbisida, antara lain.
Dalam produksi Rayón dan Celofán
Dengan CS2 Xantatos disiapkan yang merupakan senyawa yang digunakan dalam pembuatan Rayón dan Celofán.
Untuk mendapatkan sutra atau rayon buatan, ini didasarkan pada selulosa yang diobati dengan alkali dan karbon disulfida CS2 dan berubah menjadi selulosa xantat, larut dalam alkali. Solusi ini kental dan karenanya disebut "viscosa".
Viscose dibuat di bawah tekanan melalui lubang yang sangat kecil di dalam bak mandi asam. Di sini selulosa xantat diubah lagi menjadi selulosa yang tidak larut dan utas panjang dan cerah terbentuk.
Benang atau filamen dapat diputar untuk memberikan bahan yang dikenal sebagai Rayón.
(1) Selulosa + NaOH → Alkali-Celulosa
ROH + NaOH → Rona
(2) alkali-selulosa + karbon disulfida → selulosa xantat
Rona + S = C = S → RO -C (= S) -SNA
(3) xantat selulosa + asam → selulosa (filamen)
RO -C (= S) -SNA + Asam → ROH
 Pakaian dibuat dengan rayon, serat yang manufakturnya berpartisipasi karbon disulfida. TOBIAS "Take" Maier [CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Pakaian dibuat dengan rayon, serat yang manufakturnya berpartisipasi karbon disulfida. TOBIAS "Take" Maier [CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. Jika selulosa diendapkan dengan melewati xantato melalui slot sempit, selulosa diregenerasi dalam bentuk lembaran tipis yang membentuk selofan. Ini dilunakkan dengan gliserol dan digunakan sebagai film pelindung objek.
 Cellophane diproduksi dengan bantuan karbon disulfida. Penulis: Hans Braxmeier. Sumber: Pixabay.
Cellophane diproduksi dengan bantuan karbon disulfida. Penulis: Hans Braxmeier. Sumber: Pixabay. Dalam produksi karbon tetrachloride
Karbon disulfida bereaksi dengan klorin CL2 Untuk memberikan karbon tetrachloride CCL4, yang merupakan pelarut penting yang bukan bahan bakar.
Dapat melayani Anda: chlorobenzene (c6h5cl)CS2 + 3 Cl2 → CCL4 + S2Cl2
Dalam beberapa aplikasi
Karbon disulfida berpartisipasi dalam vulkanisasi karet dingin.
Xantatos disiapkan dengan CS2 Mereka digunakan dalam pengapungan mineral.
Kegunaan lama
CS2 Ini adalah racun bagi organisme hidup. Sebelumnya itu digunakan untuk menghancurkan hama seperti tikus, marmut dan semut, menuangkan cairan di setiap ruang tertutup tempat hewan -hewan ini tinggal (burrow dan hormigueros))).
Ketika uap beracun padat digunakan untuk tujuan ini, mereka mengakhiri setiap organisme hidup yang berada di ruang terbatas.
Itu juga digunakan sebagai antihelmintik untuk hewan dan untuk menghilangkan larva dari moscardon dari perut kuda.
Di bidang pertanian itu digunakan sebagai insektisida dan nematicide, untuk fumigasi tanah, untuk pengemasan pembibitan, lumbung, silo dan pabrik sereal. Mobil kereta api, kapal dan tongkang juga difumigasi.
 Petani pada tahun 1904 Menginap tanah dengan karbon disulfida untuk memerangi wabah tanaman anggur. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/lisensi/lisensi lama/FDL-1.2.html)]. Sumber: Wikimedia Commons.
Petani pada tahun 1904 Menginap tanah dengan karbon disulfida untuk memerangi wabah tanaman anggur. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/lisensi/lisensi lama/FDL-1.2.html)]. Sumber: Wikimedia Commons. Semua kegunaan ini dilarang karena kemunduran dan toksisitas CS yang tinggi2.
Risiko
CS2 Itu sangat mudah terbakar. Banyak reaksi Anda dapat menyebabkan kebakaran atau ledakan. Campuran uap mereka dengan udara bersifat eksplosif. Saat meradang menghasilkan gas yang menjengkelkan atau beracun.
Karbon disulfida untuk saluran air tidak boleh dituangkan, karena dalam tabung ada campuran CS2 dan udara yang dapat menyebabkan ledakan jika dinyalakan secara tidak sengaja.
Uapnya api secara spontan berhubungan dengan percikan api atau permukaan panas.
Karbon disulfida sangat mengiritasi mata, kulit, dan selaput lendir.
Jika sistem saraf pusat dihirup atau dicerna dengan serius, sistem kardiovaskular, mata, ginjal dan hati. Itu juga dapat diserap melalui kulit yang menyebabkan kerusakan.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2020). Karbon disulfida. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Mopper, k. Dan Kieber, D.J. (2002). Fotokimia dan bersepeda karbon, sulfur, nitrogen dan pospherus. Dalam biogeokimia bahan organik terlarut laut. Pulih dari scientedirect.com.
- Meyer, b. (1977). Penggunaan industri belerang dan komposinya. Karbon disulfida. Di belerang, energi, dan kecemburuan. Pulih dari scientedirect.com.
- Pohaniish, r.P. (2012). C. Karbon disulfida. Dalam Buku Pegangan Sittig tentang bahan kimia dan karsinogen yang beracun dan berbahaya (edisi keenam). Pulih dari scientedirect.com.
- Morrison, r.T. dan Boyd, R.N. (2002). Kimia organik. Edisi ke -6. Prentice-Hall.
- Windholz, m. et al. (Editor) (1983). Indeks Merck. Eneritedia bahan kimia, obat -obatan, dan biologis. Edisi kesepuluh. Merck & Co., Inc.

