Struktur Sulfur Dioksida (SO2), Properti, Penggunaan, Risiko

- 1777
- 439
- Tommie Smith
Dia sulfur dioksida Ini adalah senyawa gas anorganik yang dibentuk oleh sulfur (S) dan oksigen (O), menjadi formula kimianya begitu2. Ini adalah gas tidak berwarna dengan aroma yang menjengkelkan dan mencekik. Selain itu, ini adalah larutan asam pembentukan air yang larut dalam air. Gunung berapi mengeluarkannya menuju atmosfer selama letusan.
Ini adalah bagian dari siklus sulfur biologis dan geokimia, tetapi diproduksi dalam jumlah besar oleh aktivitas manusia tertentu seperti pemurnian minyak dan bahan bakar fosil yang terbakar (batubara atau diesel misalnya).
 Sulfur dioksida begitu2 dikeluarkan oleh gunung berapi selama letusan. Brocken Inaglory [CC BY-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons.
Sulfur dioksida begitu2 dikeluarkan oleh gunung berapi selama letusan. Brocken Inaglory [CC BY-S (https: // CreativeCommons.Org/lisensi/by-sa/3.0)]. Sumber: Wikimedia Commons. SO2 Ini adalah zat pereduksi yang memungkinkan bubur kertas tetap berkulit putih setelah pencucian uang dengan senyawa lain. Ini juga berfungsi untuk menghilangkan sisa -sisa klorin di dalam air yang telah diobati dengan ahli kimia ini.
Ini digunakan untuk menyimpan beberapa jenis makanan, untuk mendisinfeksi wadah di mana fermentasi jus anggur terjadi untuk menghasilkan anggur atau gandum untuk membuat bir.
Ini juga digunakan sebagai fungisida di bidang pertanian, untuk mendapatkan asam sulfat, sebagai pelarut dan sebagai perantara dalam reaksi kimia.
SO2 Hadir di atmosfer berbahaya bagi banyak tanaman, di dalam air mempengaruhi ikan dan juga salah satu dari mereka yang bertanggung jawab atas "hujan asam" yang merusak bahan yang diciptakan oleh manusia.
[TOC]
Struktur
Molekul sulfur dioksida simetris dan membentuk sudut. Sudutnya adalah karena begitu2 Ini memiliki beberapa elektron kesepian, yaitu elektron yang membentuk tautan dengan atom apa pun tetapi gratis.
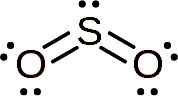 Lewis Struktur sulfur dioksida di mana bentuk sudutnya dan pasangan elektron bebas diamati. Whittlemario [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Lewis Struktur sulfur dioksida di mana bentuk sudutnya dan pasangan elektron bebas diamati. Whittlemario [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Tata nama
- Sulfur dioksida
- Belerang anhidrida
- Oksida belerang.
Properti
Keadaan fisik
Gas tidak berwarna.
Berat molekul
64.07 g/mol
Titik lebur
-75,5 ºC
Titik didih
-10.05 ºC
Kepadatan
Gas: 2.26 hingga 0 ° C (relatif terhadap udara, yaitu kepadatan udara = 1). Ini berarti lebih berat dari udara.
Cairan: 1.4 A -10 ° C (relatif terhadap air, yaitu kepadatan air = 1).
Kelarutan
Soluble Air: 17,7% pada 0 ° C; 11,9% pada 15 ° C; 8,5% pada 25 ° C; 6,4% pada suhu 35 ° C.
Larut dalam etanol, dialyl eter, aseton dan kloroform. Ini kurang larut dalam pelarut non -polar.
ph
Solusi SOS berair2 Mereka bersifat asam.
Sifat kimia
SO2 Ini adalah agen pengurangan dan pengoksidasi yang kuat. Di hadapan udara dan katalis mengoksidasi demikian3.
Sw2 + SALAH SATU2 → Jadi3
Pasangan elektron soliter membuatnya kadang -kadang berperilaku sebagai dasar Lewis, dengan kata lain, dapat bereaksi dengan senyawa di mana ada atom yang hilang elektron.
Itu dapat melayani Anda: pengarsipan besi: properti, bagaimana mereka dibuat, toksisitas, penggunaanJika begitu2 Ini dalam bentuk gas dan kering tidak menyerang besi, baja, paduan tembaga-nikel, atau nikel-chrome-hydrro. Namun, jika berada dalam keadaan cair atau lembab, itu menghasilkan korosi dengan logam ini.
SO2 Cairan dengan 0,2% air atau lebih menghasilkan korosi besi, kuningan, dan tembaga yang kuat. Ini korosif untuk aluminium.
Saat cairan, Anda juga dapat menyerang beberapa plastik, karet, dan pelapis.
SOS SO yang berair2
SO2 Itu sangat larut dalam air. Dipertimbangkan untuk waktu yang lama bahwa dalam bentuk asam sulfur air h2Sw3, Tetapi keberadaan asam ini belum ditunjukkan.
Dalam solusi SO2 Di dalam air, saldo berikut terjadi:
Sw2 + H2Atau ⇔ begitu2.H2SALAH SATU
Sw2.H2Atau ⇔ hso3- + H3SALAH SATU+
Hso3- + H2Atau ⇔ begitu32- + H3SALAH SATU+
Dimana hso3- Itu adalah ion bisulfit dan begitu32- Itu adalah ion sulfit. Ion sulfit begitu32- Itu terjadi terutama ketika alkali ditambahkan ke solusi SO2.
Solusi SOS berair2 Mereka memiliki sifat mengurangi, terutama jika mereka basa.
Properti lainnya
- Ini sangat stabil dibandingkan dengan panas, bahkan hingga 2000 ° C.
- Itu tidak mudah terbakar.
Memperoleh
SO2 Ini diperoleh dengan pembakaran belerang di udara, meskipun sejumlah kecil bentuk juga terbentuk3.
S + o2 → Jadi2
Ini juga dapat diproduksi dengan pemanasan di udara berbagai sulfida, membakar mineral pirit dan mineral yang mengandung sulfida, antara lain.
Dalam kasus pirit besi, saat mengoksidasi besi oksida (III) dan SO diperoleh2:
4 fes2 + 11 o2 → 2 Iman2SALAH SATU3 + 8 Jadi2↑
Kehadiran di alam
SO2 Ini dilepaskan ke atmosfer dengan aktivitas gunung berapi (9%) tetapi juga berasal dari aktivitas alam lainnya (15%) dan oleh aksi manusia (76%).
Letusan gunung berapi yang meledak menyebabkan fluktuasi atau variasi tahunan yang signifikan2 di atmosfer. Diperkirakan 25% dari SO2 dipancarkan oleh gunung berapi dicuci oleh hujan sebelum mencapai stratosfer.
Sumber alami adalah yang paling berlimpah dan disebabkan oleh siklus biologis belerang.
Di daerah perkotaan dan industri, sumber manusia mendominasi. Aktivitas manusia utama yang memproduksinya adalah pembakaran bahan bakar fosil, seperti batubara, bensin dan diesel. Sumber manusia lainnya adalah kilang minyak, tanaman kimia dan produksi gas.
 Aktivitas manusia seperti pembakaran batu bara untuk listrik adalah sumber polusi dengan demikian2. ADREM68 [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons.
Aktivitas manusia seperti pembakaran batu bara untuk listrik adalah sumber polusi dengan demikian2. ADREM68 [CC BY-SA (https: // CreativeCommons.Org/lisensi/by-sa/4.0)]. Sumber: Wikimedia Commons. Pada mamalia itu dihasilkan dengan cara endogen, yaitu, di dalam tubuh hewan dan manusia karena metabolisme asam amino yang mengandung sulfur (S), terutama L-sistein.
Dapat melayani Anda: Elemen Cair: Apa itu dan contohAplikasi
Dalam produksi asam sulfat
Salah satu aplikasi terpenting dari SO2 Itu dalam mendapatkan asam sulfat h2Sw4.
2 Jadi2 + 2 h2Atau + o2 → 2 H2Sw4
Di industri makanan olahan
Sulfur dioksida digunakan sebagai pengawet makanan dan penstabil, sebagai agen untuk kontrol kelembaban dan sebagai pengubah rasa dan tekstur produk yang dapat dimakan tertentu.
Ini juga digunakan untuk mendisinfeksi peralatan yang bersentuhan dengan bahan makanan, peralatan fermentasi, seperti pabrik dan vital, wadah makanan, dll.
Ini memungkinkan untuk menghemat buah dan sayuran, meningkatkan kehidupannya di rak supermarket, mencegah hilangnya warna dan rasa dan membantu dalam retensi vitamin C (asam askorbat) dan karoten (prekursor vitamin A).
 Buah kering tetap bebas dari jamur dan bakteri berkat SO2. Penulis: Isabel Ródenas. Sumber: Pixabay.com
Buah kering tetap bebas dari jamur dan bakteri berkat SO2. Penulis: Isabel Ródenas. Sumber: Pixabay.com Itu berfungsi untuk menjaga anggur, karena menghancurkan bakteri, jamur, dan ragi yang tidak diinginkan. Ini juga digunakan untuk mensterilkan dan mencegah pembentukan nitrosamin dalam bir.
 Peralatan fermentasi gandum untuk mendapatkan bir sterilisasi dengan begitu2. Penulis: CerideBbie. Sumber: Pixabay.
Peralatan fermentasi gandum untuk mendapatkan bir sterilisasi dengan begitu2. Penulis: CerideBbie. Sumber: Pixabay. Ini juga digunakan untuk merendam biji -bijian jagung, untuk memutihkan gula bit dan sebagai antimikroba dalam pembuatan sirup jagung fruktosa tinggi.
Sebagai pelarut dan reaktif
Itu telah banyak digunakan sebagai pelarut yang tidak seperti. Meskipun ini bukan pelarut pengion, ini berguna sebagai pelarut yang bebas dari proton untuk aplikasi analitik dan reaksi kimia tertentu.
Ini digunakan sebagai pelarut dan reagen dalam organik, perantara dalam produksi senyawa lain seperti klorin dioksida, asetil klorida dan dalam sulfonasi minyak.
Sebagai agen peredam
Ini digunakan sebagai agen pereduksi meskipun tidak begitu kuat, dan dalam larutan basa ion sulfit terbentuk yang merupakan agen pereduksi yang lebih energik.
Dalam beberapa aplikasi
SO2 Itu juga digunakan:
- Di pertanian seperti fungisida dan pengawet anggur setelah panen.
- Untuk memproduksi hidrosulfit.
- Untuk memutihkan kayu dan kertas kertas, karena memungkinkan menstabilkan pulpa setelah pencucian dengan hidrogen peroksida h2SALAH SATU2; SO2 bertindak dengan menghancurkan h2SALAH SATU2 tersisa dan dengan demikian menjaga kecerahan bubur kertas, seperti h2SALAH SATU2 dapat menyebabkan pembalikan kecerahan.
- Untuk memutihkan serat tekstil dan artikel anyaman.
- Untuk mengolah air, itu menghilangkan sisa klorin yang tersisa setelah klorinasi air minum, air limbah atau perairan industri.
- Dalam pemurnian mineral dan logam, sebagai agen pereduksi besi selama pemrosesan mineral.
- Dalam pemurnian minyak untuk menangkap oksigen dan menunda korosi, dan sebagai pelarut ekstraksi.
Dapat melayani Anda: menyeimbangkan persamaan kimia- Sebagai antioksidan.
- Sebagai penetralisir alkalis di manufaktur kaca.
- Dalam baterai lithium sebagai zat pengoksidasi.
Efek dari SO2 endogen
Studi tertentu telah mengungkapkan bahwa SO2 endogen atau diproduksi oleh organisme itu sendiri memiliki efek menguntungkan pada sistem kardiovaskular, termasuk regulasi fungsi jantung dan relaksasi pembuluh darah.
Saat SO terjadi dalam organisme2 Itu menjadi turunannya bisulfite hso3- dan sulfit begitu32-, yang memberikan efek vasorelajador dari arteri.
SO2 Penurunan endogen hipertensi, mencegah perkembangan aterosklerosis dan melindungi jantung kerusakan miokardium. Ini juga memberikan tindakan antioksidan, menghambat peradangan dan apoptosis (kematian sel terprogram).
Karena alasan ini, itu bisa menjadi terapi baru yang mungkin untuk penyakit kardiovaskular.
 Hati bisa mendapat manfaat dari SO2 diproduksi oleh organisme. Penulis: OpenClipart-Vektor. Sumber: Pixabay.
Hati bisa mendapat manfaat dari SO2 diproduksi oleh organisme. Penulis: OpenClipart-Vektor. Sumber: Pixabay. Risiko
- Paparan begitu2 Gas dapat menyebabkan luka bakar di mata, kulit, tenggorokan dan selaput lendir, kerusakan pada bronkus dan paru -paru.
- Beberapa penelitian melaporkan bahwa ia memiliki risiko potensial kerusakan pada bahan genetik sel mamalia dan manusia.
- Itu korosif. Itu tidak mudah terbakar.
Ekotoksisitas
Sulfur dioksida adalah gas polutan yang paling umum di atmosfer, terutama di daerah perkotaan dan industri.
Kehadirannya di atmosfer berkontribusi pada "hujan asam" yang disebut SO yang berbahaya bagi organisme air, ikan, vegetasi tanah dan korosi terhadap bahan yang dibuat oleh manusia.
 Monumen rusak karena hujan asam. Nino Barbieri [CC BYS-S (http: // CreativeCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Monumen rusak karena hujan asam. Nino Barbieri [CC BYS-S (http: // CreativeCommons.Org/lisensi/by-sa/3.0/]]. Sumber: Wikimedia Commons. SO2 Itu beracun bagi ikan. Tanaman hijau sangat sensitif terhadap begitu2 atmosfer. Alfalfa, kapas, gandum dan gandum rusak dengan tingkat lingkungan yang rendah, sementara kentang, bawang dan jagung jauh lebih tahan.
Efek dari menelannya dengan makanan
Meskipun tidak berbahaya bagi orang sehat, bila digunakan dalam konsentrasi yang direkomendasikan oleh lembaga kesehatan yang berwenang, SO2 dapat menginduksi asma untuk orang sensitif yang menelan makanan.
 Orang sensitif dapat menderita asma dengan menelan makanan dengan sedikit2. Suraj at Malayalam Wikipedia [domain publik]. Sumber: Wikimedia Commons.
Orang sensitif dapat menderita asma dengan menelan makanan dengan sedikit2. Suraj at Malayalam Wikipedia [domain publik]. Sumber: Wikimedia Commons. Makanan yang biasanya mengandung buah kering, minuman ringan buatan dan minuman beralkohol.
Referensi
- ATAU.S. Perpustakaan Kedokteran Nasional. (2019). Dioksida sulfur. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.
- Huang, dan. et al. (2016). Sulfur dioksida endogen: Keluarga gasotransmitter baru dalam sistem kardiovaskular. Longev Sel Med Oxid. 2016; 2016: 8961951. NCBI pulih.Nlm.Nih.Pemerintah.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia anorganik canggih. Edisi keempat. John Wiley & Sons.
- Windholz, m. et al. (Editor) (1983). Indeks Merck. Eneritedia bahan kimia, obat -obatan, dan biologis. Edisi kesepuluh. Merck & Co., Inc.
- Roti, x. (2011). Oksida Sulfur: Sumber, Eksposur dan Efek Kesehatan. Efek kesehatan sulfur oksida. Dalam ensiklopedia kesehatan lingkungan. Pulih dari scientedirect.com.
- Tricker, R. dan penipuan, s. (1999). Polutan dan kontaminan. Sulfur dioksida. Dalam persyaratan lingkungan untuk peralatan elektromekanis dan elektronik. Pulih dari scientedirect.com.
- Bleam, W. (2017). Kimia asam-basa. Oksida belerang. Dalam Kimia Tanah dan Lingkungan (Edisi Kedua). Pulih dari scientedirect.com.
- Freedman, b.J. (1980). Sulfur dioksida dalam makanan dan minuman: penggunaan pengawet dan pengaruhnya terhadap asma. Br j dada. 1980; 14 (2): 128-34. NCBI pulih.Nlm.Nih.Pemerintah.
- Craig, k. (2018). Tinjauan kimia, penggunaan pestisida, dan nasib lingkungan sulfur dioksida, seperti yang digunakan di California. Dalam ulasan kontaminasi lingkungan dan toksikologi. Volume 246. Tautan pulih.Peloncat.com.
- « Struktur Silikon Nitruro (SI3N4), Properti, Perolehan, Penggunaan
- Struktur aluminium polyloride, sifat, memperoleh, menggunakan »

