Persamaan Arrhenius
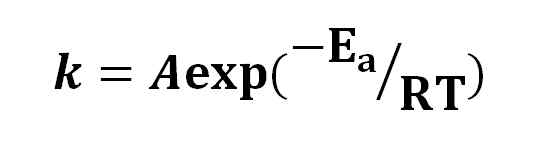
- 2484
- 87
- Pete Lesch
Apa persamaan arrhenius?
Itu Persamaan Arrhenius Ini adalah pendekatan yang menghubungkan konstanta kecepatan reaksi kimia tergantung pada suhu. Didirikan pada tahun 1899 oleh ahli kimia Swedia Svante Arrhenius (1859-1927). Mewakili salah satu kontribusi paling mendasar dalam pengembangan kinetika kimia.
Persamaan ini berutang basis teoretisnya kepada banyak ilmuwan, termasuk Wihelmy (1850), Berthelot (1862) dan j. J. Hood (1885). Tetapi pengaruh terbesar dikaitkan dengan penciptaan persamaan Arrhenius dengan pekerjaan yang dilakukan oleh Van't Hoof (1884), yang menetapkan ketergantungan pada konstanta kesetimbangan reaksi kimia dengan suhu.
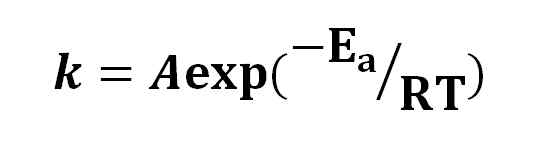 Persamaan Arrhenius. Sumber: Gabriel Bolívar.
Persamaan Arrhenius. Sumber: Gabriel Bolívar. Berdasarkan persamaan Arrhenius, gagasan bahwa peningkatan 10 ºC telah menyebabkan duplikasi kecepatan reaksi telah disebarluaskan. Interpretasi lain yang menjadi molekul membutuhkan energi aktivasi untuk bereaksi satu sama lain.
Demikian juga, ditunjukkan bahwa persamaan Arrhenius adalah bentuk lain dari disintegrasi eksponensial di mana nilai konstanta kecepatan tergantung pada eksponen -eke/Rt, di mana eke adalah energi aktivasi.
Persamaan dan Penjelasan
Persamaan Arrhenius memiliki dua ekspresi berikut:
K = ae-EA/RT
Bentuk persamaan yang digunakan dalam kimia dan terkait dengan mol reagen.
K = ae-EA/KBT
Bentuk persamaan yang digunakan dalam fisika dan terkait dengan lebih banyak molekul, dibandingkan dengan mol.
Keduanya berasal dari persamaan kuku van untuk variasi konstanta kesetimbangan k tergantung pada suhu. Persamaan dasarnya adalah:
d (ln k)/dt = eke/Rt2
Itu dapat melayani Anda: dibenzalacetona: sifat, mekanisme reaksi, penggunaan, risikoYang terintegrasi dengan asumsi ituke tidak tergantung pada suhu. Jadi kita punya:
ln k = - eke/Rt + ln a
Di mana ln a adalah konstanta integrasi. Ketika fungsi eksponensial diterapkan di kedua sisi persamaan, kami memperoleh persamaan Arrhenius yang sudah diperkenalkan.
Komponen
k
Itu adalah konstanta kecepatan reaksi kimia. Nilainya dapat diperoleh, selain penggunaan persamaan Arrhenius, dengan penerapan hukum kecepatan. Mewakili jumlah tabrakan antara partikel yang dihasilkan oleh reaksi per detik.
KE
Ini adalah apa yang disebut faktor pra-eksponensial, yang mewakili frekuensi tabrakan antara molekul reagen dengan orientasi geometris yang sesuai yang mungkin atau mungkin tidak menghasilkan reaksi kimia. Jika variasi suhu sangat besar, biasanya dianggap konstan. Faktor ini memiliki formula sendiri:
A = z ρ
Di mana z dikenal sebagai faktor frekuensi atau tabrakan, dan ρ faktor geometris atau sterik yang menunjukkan orientasi relatif molekul pada titik tabrakan. Konstanta A memiliki unit yang sama dengan konstanta kecepatan. Dalam hal tidak ada energi aktivasi, besarnya a akan sama dengan k.
DANke
Itu adalah energi aktivasi, yang mewakili energi ambang sebelum mencapai stat transisi.
Energi aktivasi memiliki unit KJ/mol. Tetapi dalam perhitungan J/mol digunakan sebagai satu unit. Tanda paling sedikit (-) yang mendahului eke, Itu berfungsi untuk menunjukkan bahwa peningkatannya menghasilkan penurunan kecepatan reaksi, serta penurunannya menghasilkan peningkatan kecepatan reaksi.
Dapat melayani Anda: kromatografi gasRt
Mewakili energi kinetik rata -rata. Sementara itu, R adalah konstanta gas universal, menjadi salah satu nilai yang paling banyak digunakan 8.31 j · k-1· Mol-1. Dan T adalah suhu absolut yang dinyatakan dalam Kelvin (k).
Dan
Ini adalah dasar logaritma alami atau Neperian, memiliki nilai 2.71828.
Dan-EA/RT
Ini adalah fraksi molekul bereaksi dengan energi yang sama atau berlebih dalam kaitannya dengan energi aktivasi.
Aplikasi
Sebagian besar aplikasi persamaan Arrhenius berasal dari penggunaan dalam penentuan konstanta kecepatan; dan dengan ekstensi, kecepatan reaksi, serta energi aktivasinya.
Sebagai contoh, model kimia telah dikembangkan berdasarkan persamaan Arrhenius, yang dapat memprediksi sifat -sifat bahan sebagai perubahan suhu mereka, diterapkan di bidang geologi, konstruksi, rekayasa bahan, dan dalam ilmu makanan.
Telah diterapkan, meskipun dengan kritik tertentu, persamaan Arrhenius dalam kinetika reaksi solid state. Ini juga telah digunakan untuk mengkarakterisasi respons tanaman terhadap stres air.
Persamaan Arenhius berfungsi sebagai dasar untuk penciptaan model matematika, yang mengukur efek suhu pada masa manfaat sel hidrida logam nikel atau baterai.
Demikian juga, berdasarkan persamaan Arrhenius, laju dekomposisi limbah babi, dan minyak goreng ditetapkan, di bawah berbagai kadar air.
Latihan terpecahkan
Latihan 1
Berapa energi aktivasi suatu reaksi jika ditemukan bahwa kecepatannya konstan tiga kali ketika suhu naik dari 600 K menjadi 610 K?
Dapat melayani Anda: asam fenoksiketat: sintesis, prosedur, penggunaan, risikoMulai dari persamaan Arrhenius:
k = a · e-EA/RT
Kami menghapus faktor A:
A = k1 / (e-EA/RT1)
Tapi karena kita memiliki dua suhu, t1 dan T2, Akan ada dua konstanta kecepatan: k1 dan k2. Faktor A tidak berubah, sehingga kita bisa mencocokkannya untuk suhu kedua:
k1 / (e-EA/RT1) = k2 / (e-EA/RT2)
Dan membersihkan eke kami akan memiliki:
DANke = R (ln k2/k1) / (1 / t1 - 1/t2)
seperti apa2 tiga kali lebih besar dari k1,
k2 / k1 = 3
ln (3) = 1.099
Dan di sisi lain:
1 / t1 = 1/600 K = 1.66 x 10-3 K-1
1 / t2 = 1/610 k = 1.64 x 10-3 K-1
Mengganti kemudian:
DANke = (8.31 j · k-1· Mol-1) (1.099) / (1.66 x 10-3 K-1 - 1.64 x 10-3 K-1)
= 456.5 kJ · mol-1
Latihan 2
Dalam reaksi fase gas, energi aktivasi sama dengan 103 kJ/mol, dan konstanta kecepatan adalah 0.085 mnt-1. Hitung konstanta kecepatan pada 323 K.
Dari ungkapan sebelumnya kami menghapus ln k2/k1:
ln k2/k1 = (Eke/R) (1 /t1 - 1/t2)
Mengembangkan bagian yang tepat dari persamaan:
ln k2/k1 = (103.000 j · mol-1 / 8.31 j · k-1· Mol-1) (1/273 K - 1/323 K)
ln k2/k1 = 6.99
Mengambil Antilogaritma:
k2/k1 = 1.086
k2 = (k1) (1.086)
= (0.085 mnt-1) (1.086)
= 0.092 mnt-1
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Walter J. Moore. (1963). Kimia Fisik. Dalam Kinetika Kimia. Edisi Keempat, Longmans.
- Iran. Levine. (2009). Prinsip -prinsip fisikokimia. Edisi Keenam. MC Graw Hill.
- Wikipedia. (2020). Persamaan Arrhenius. Diperoleh dari: di.Wikipedia.org
- Guenevieve del Mundo et al. (10 September 2020). Persamaan Arrhenius. Pulih dari: chem.Librettexts.org
- Clark Jim. (2013). Tingkat konstanta dan persamaan Arrhenius. Pulih dari: chemguide.bersama.Inggris
- Para editor Eeritlopaedia Britannica. (2020). Persamaan Arrhenius. Dipulihkan dari: Britannica.com
- Helmestine, Anne Marie, PH.D. (28 Agustus 2020). Formula dan contoh persamaan Arrhenius. Pulih dari: thinkco.com

