Energi aktivasi

- 1689
- 341
- Tommie Smith
Kami menjelaskan apa energi aktivasi, rumusnya, unit, bagaimana ia dihitung dan kami memberikan beberapa contoh
Apa itu energi aktivasi?
Itu energi aktivasi (DANke) Ini didefinisikan sebagai energi minimum yang diperlukan untuk reaksi kimia dilakukan. Dengan kata lain, itu adalah penghalang energi yang harus diatasi sehingga reagen dapat menjadi produk.
Energi aktivasi dapat dilihat dalam aksi dalam kehidupan sehari -hari. Memang, kita semua tahu bahwa, saat membuka kunci bagian gas di dapur, itu tidak segera terbakar ketika bersentuhan dengan udara.
Sehingga reaksi pembakaran dimulai, perlu untuk memberikan percikan atau api yang cocok. Percikan ini atau api ini mewakili energi aktivasi dari reaksi pembakaran.
Mengapa Energi Aktivasi Diperlukan?
Untuk memahami alasan mengapa reaksi membutuhkan energi minimum untuk terjadi, penting untuk dipahami, di tempat pertama, bagaimana mereka terjadi. Untuk dua atom atau molekul bereaksi, mereka harus bertabrakan terlebih dahulu. Selain itu, mereka harus melakukannya dengan orientasi yang tepat sehingga ikatan kimia baru dapat dibentuk dan orang tua dapat rusak.
Namun, bahkan jika kedua molekul diarahkan satu sama lain dengan orientasi yang sempurna, ini tidak memastikan bahwa tabrakan yang efektif diberikan, karena tolakan antara elektron permukaan molekul.
Untuk alasan ini, perlu bahwa, selain orientasi yang benar, molekul juga melakukan perjalanan dengan kecepatan atau dengan energi kinetik minimum yang memastikan bahwa tabrakannya cukup kuat untuk menangkal penolakan elektron.
Energi kinetik minimum yang diperlukan pada tingkat mikroskopis ini adalah yang diterjemahkan ke dalam energi aktivasi reaksi.
Dapat melayani Anda: lithium bromide: struktur, sifat, penggunaan, risikoApa yang terlihat dalam diagram energi?
Diagram energi adalah representasi grafik yang menunjukkan bagaimana energi reagen bervariasi saat mereka diubah menjadi produk. Dalam diagram ini, seperti yang disajikan di bawah ini, mudah untuk melihat dan menafsirkan energi aktivasi.

Dalam grafik ini garis biru menunjukkan energi saat reaksi berlangsung. Di sini Anda dapat melihat bahwa, untuk menjadi produk, reagen harus terlebih dahulu mengatasi bukit untuk mencapai keadaan transisi. Kalau tidak, mereka akan dikembalikan ke keadaan awal mereka.
Ketinggian bukit ini adalah energi aktivasi yang tepat. Jika mungkin untuk diatasi, sisa jalan menurun, dan reagen selesai dengan cepat menjadi produk.
Unit Energi Aktivasi
Energi aktivasi adalah besarnya intensif yang diekspresikan dalam unit energi di atas massa atau mol. Karena ada unit energi yang berbeda dan unit massa yang berbeda, energi aktivasi dapat diekspresikan dalam beberapa unit yang berbeda. Namun, yang paling sering digunakan dalam kimia adalah:
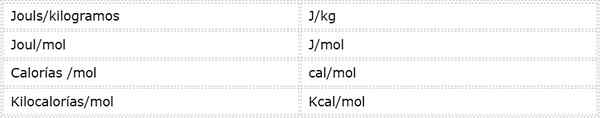
Unit mana yang digunakan tergantung pada data dari mana ia dihitung, atau penggunaan yang akan diberikan dalam perhitungan lain.
Formula Energi Aktivasi
Energi aktivasi terkait dengan kecepatan reaksi. Faktanya, semakin besar energi aktivasi, semakin rendah kecepatan. Hubungan ini diekspresikan secara matematis melalui persamaan Arrhenius, yang menghubungkan konstanta kecepatan reaksi terhadap suhu.
Dapat melayani Anda: Benedict Reagent: Untuk apa, komponen, persiapan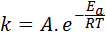
Dalam persamaan ini, k Itu adalah konstanta kecepatan reaksi, danke Ini adalah energi aktivasi, R adalah konstanta gas ideal, T adalah suhu absolut dan disebut faktor pra-eksponensial arrhenius, juga disebut faktor tabrakan.
Persamaan ini dapat diatur ulang untuk diberikan:
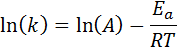
Jika nilai A untuk reaksi diketahui, maka energi aktivasi dapat diperoleh dengan membersihkan persamaan sebelumnya. Namun, ini bukan cara di mana energi aktivasi suatu reaksi biasanya ditentukan. Biasanya konstanta kecepatan ditentukan pada dua atau lebih suhu, yang membuatnya tidak perlu diketahui.
Bagaimana energi aktivasi dihitung?
Energi aktivasi ditentukan dari nilai konstanta kecepatan pada suhu yang berbeda. Setidaknya dua nilai k diukur pada nilai t yang berbeda untuk menghitung energi aktivasi tanpa mengetahui, yang biasanya terjadi.
Tergantung pada berapa banyak nilai k Mereka memiliki, Anda dapat menghitung danke Dalam dua cara:
1. Saat Anda punya k pada dua suhu
Dalam kasus ini, lebih mudah untuk memulai dari bentuk pertama persamaan Arrhenius. Jika kita menelepon k1 ke kecepatan konstan pada suhu T1 Dan k2 ke kecepatan konstan pada suhu T2, Kemudian kita dapat menulis persamaan Arrhenius dua kali:
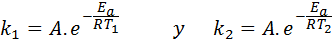
Sekarang, kita dapat membagi salah satu dari dua persamaan antara yang lain untuk membatalkan:
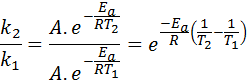
Kemudian, mengambil logaritma Neperian di kedua sisi dan memecahkan untuk Eke, diperoleh:
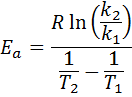
2. Saat Anda punya k Lebih dari dua suhu
Dalam kasus di mana ada beberapa penentuan konstanta kecepatan pada berbagai suhu, lebih disukai untuk menemukan energi aktivasi secara grafis atau melalui regresi linier. Ini didasarkan pada persamaan dalam bentuk logaritmik, yang memiliki bentuk garis:
Itu dapat melayani Anda: persamaan clausius-clapeyron: untuk apa, contoh, latihan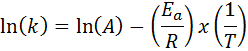
Jika kita membuat grafik ln (k) versus (1/t), kita akan mendapatkan garis lurus yang memotong ke sumbu Dan di ln (a) dan yang kemiringannya sama dengan -(eke/R). Dari sana energi aktivasi diperoleh.
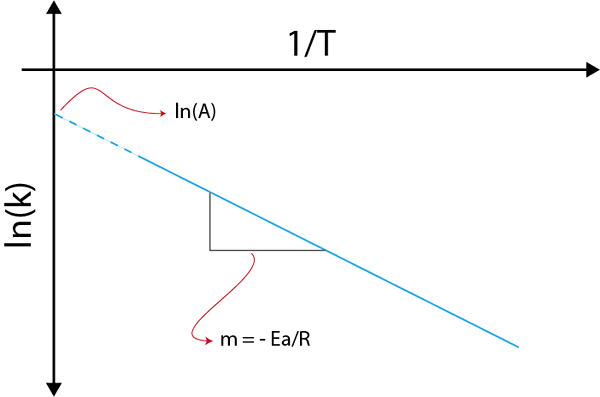 Grafik Arrhenius untuk menentukan energi aktivasi
Grafik Arrhenius untuk menentukan energi aktivasi Contoh Perhitungan Energi Aktivasi
Contoh 1
Konstanta kecepatan reaksi urutan pertama ditentukan pada dua suhu yang berbeda. 298 K memiliki nilai 0.058 s-1, sedangkan pada 350 K nilainya meningkat menjadi 0,425 detik-1. Tentukan energi aktivasi reaksi ini dalam J/mol.
- Larutan: Karena Anda memiliki konstanta pada dua suhu, formula energi aktivasi yang ditunjukkan di atas dapat digunakan secara langsung. Karena energi diminta dalam unit J/mol, maka kita harus menggunakan konstanta gas dalam unit -unit ini:
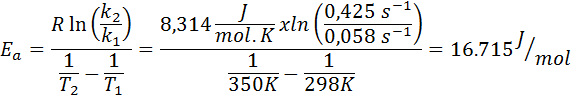
Contoh 2
Konstanta kecepatan untuk reaksi kimia orde kedua diukur pada suhu yang berbeda. Nilai disajikan dalam tabel berikut. Tentukan energi aktivasi dalam kkal/mol.
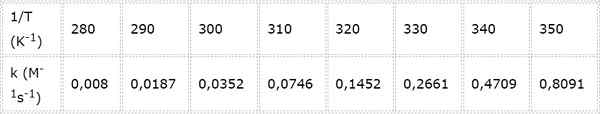
- Larutan: Seperti dalam kasus ini ada beberapa suhu, lebih baik untuk menentukan energi aktivasi secara grafis. Untuk melakukan ini, grafik LN (k) vs 1/t dibuat, yang disajikan di bawah ini.
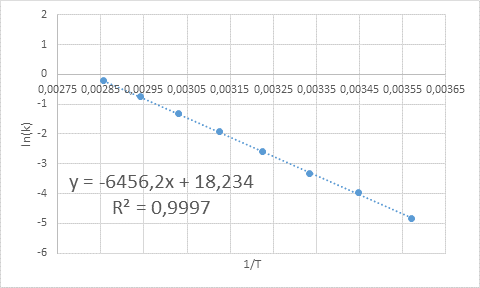 Contoh penentuan grafis energi aktivasi
Contoh penentuan grafis energi aktivasi Dari persamaan garis yang ditunjukkan dalam grafik, kemiringan diperoleh, yaitu -6456.2. Karena kemiringan (m) sama dengan - eke/R, lalu:
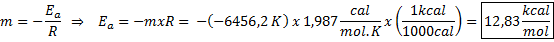
Yaitu, energi aktivasi reaksi ini adalah 12,83 kkal/mol.

