Energi ionisasi

- 1299
- 365
- Pete Lesch
Apa itu energi ionisasi?
Itu energi ionisasi, Diwakili oleh Simbol I, itu adalah jumlah minimum energi yang diperlukan untuk memulai elektron eksternal ke mol atom dalam keadaan gas, dalam keadaan mendasarnya. Dengan kata lain, itu adalah jumlah minimum energi yang diperlukan untuk mengubah mol atom netral menjadi keadaan gas menjadi mol ion dengan beban positif (karenanya namanya).
Terlihat dalam bentuk persamaan kimia, energi ionisasi akan menjadi energi yang diperlukan untuk proses berikut:
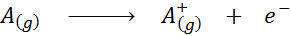
Energi ionisasi adalah ukuran langsung dari seberapa kuat elektron terluar dari elemen kimia dihubungkan. Saat mendefinisikan energi proses ionisasi keadaan gas, kontribusi atau gangguan interaksi antarmolekul yang terjadi pada keadaan cair dan padat dihindari.
Dengan cara ini, dipastikan bahwa energi ionisasi hanya tergantung pada kekuatan internal atom dan, khususnya, pada stabilitas elektron yang membentuk lapisan valensi setiap elemen.
Proses menghilangkan elektron dari lapisan Valencia adalah proses yang membutuhkan energi, jadi ini adalah proses endotermik. Untuk alasan ini, energi ionisasi selalu positif (berdasarkan konvensi, ketika energi memasuki suatu sistem dianggap positif).
Ada lebih dari satu energi ionisasi
Meskipun definisi energi ionisasi diterapkan pada atom netral yang menjadi ion positif (yaitu kation), ia juga dapat diterapkan pada penghapusan elektron ion positif berturut -turut, yaitu, spesies yang sudah mereka sudah kehilangan elektron.
Dalam hal ini, energi untuk mengionisasi atom netral menjadi yang pertama dari banyak energi ionisasi yang mungkin, karena ada satu untuk setiap elektron yang berkisar di sekitar nukleus.
Dapat melayani Anda: apa elemen gerakan?Dengan kata lain, energi yang terkait dengan semua proses berikut dianggap sebagai energi ionisasi:
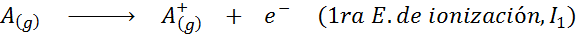
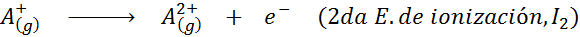
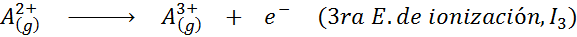
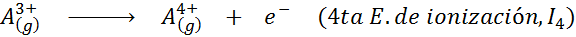
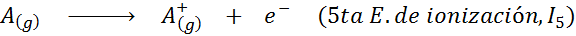
Urutan energi ionisasi berturut -turut
Untuk atom apa pun dari elemen apa pun, dipenuhi bahwa energi ionisasi akan selalu lebih besar dari semua energi ionisasi sebelumnya. Dengan kata lain, energi ionisasi berturut -turut memiliki hubungan berikut:
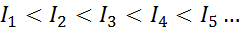
Alasan mengapa ini terjadi sangat sederhana. Energi ionisasi pertama melibatkan menghilangkan elektron ke atom netral. Namun, energi ionisasi kedua menyiratkan mengambil elektron ke atom yang telah kehilangan yang pertama.
Tidak adanya elektron meninggalkan beban bersih positif yang menarik dengan kekuatan lebih banyak elektron yang tersisa, sehingga mereka lebih sulit untuk memulai. Selain itu, ketidakhadiran ini juga mengurangi efek perisai yang dimiliki elektron pada elektron terluar, sehingga nukleus mampu menariknya lebih kuat.
Hasilnya adalah lebih sulit untuk memulai elektron kedua daripada yang pertama, dan akan lebih sulit untuk memulai yang ketiga daripada yang kedua, dan seterusnya, seperti yang dapat dilihat pada tabel energi ionisasi berikut untuk 10 elemen pertama dari tabel periodik.
Z | Elemen | Pertama | Kedua | Ketiga | Seperempat | Kelima | Keenam |
1 | H | 1312 | |||||
2 | Dia | 2373 | 5251 | ||||
3 | Li | 520 | 7300 | 11815 | |||
4 | Menjadi | 899 | 1757 | 14850 | 21005 | ||
5 | B | 801 | 2430 | 3660 | 25000 | 32820 | |
6 | C | 1086 | 2350 | 4620 | 6220 | 38000 | 47261 |
7 | N | 1400 | 2860 | 4580 | 7500 | 9400 | 53000 |
8 | SALAH SATU | 1314 | 3390 | 5300 | 7470 | 11000 | 13000 |
9 | F | 1680 | 3370 | 6050 | 8400 | 11000 | 15200 |
10 | Ne | 2080 | 3950 | 6120 | 9370 | 12200 | 15000 |
Tren energi ionisasi berkala
Energi ionisasi adalah sifat periodik yang meningkat dari kiri ke kanan dan dari bawah ke tabel periodik, seperti yang dapat dilihat dalam grafik berikut.
Dapat melayani Anda: pelebaran linier: apa itu, formula dan koefisien, contoh
Variasi I selama satu periode
Ketika kita bergerak selama periode dari kiri ke kanan, agak disebut beban nuklir yang efektif secara progresif disebut, yang tidak lebih dari beban positif nyata yang dapat "dilihat oleh elektron terluar" karena perisai elektron paling internal paling internal.
Ini berarti bahwa kekuatan yang dengannya nukleus mampu menarik elektron valencia meningkat, sehingga menjadi lebih sulit untuk merobeknya dan energi yang dibutuhkan (yaitu, energi ionisasi) menjadi lebih besar.
Variasi i di seluruh kelompok
Saat turun dalam suatu kelompok, kami menempatkan elektron dalam meningkatkan tingkat energi dan, oleh karena itu, dalam orbital atom semakin jauh dari nukleus. Untuk alasan ini, gaya nukleus menarik elektron valensi berkurang saat kita turun dalam kelompok, juga mengurangi energi ionisasi.
Bagaimana menentukan energi ionisasi?
Energi ionisasi adalah jumlah tertentu secara eksperimental melalui serangkaian teknik yang disebut, bersama -sama, spektroskopi fotoelektron.
Teknik -teknik ini didasarkan pada fenomena yang sangat mirip dengan efek fotolektrik, di mana radiasi elektromagnetik mampu memulai elektron atom, dan perbedaan antara energi radiasi dan energi kinetik dengan mana elektron ditembakkan mewakili energi ionisasi.
Berbagai teknik spektroskopi fotoelektron memungkinkan menganalisis energi yang hampir setiap elektron terkait dengan nukleusnya, apakah elektron valencia atau elektron internal.
Contoh energi ionisasi
Energi ionisasi pertama gas mulia
Gas mulia memiliki konfigurasi elektronik paling stabil dari semua elemen tabel periodik. Karena alasan ini, mereka juga memiliki energi ionisasi terbesar. Energi ionisasi pertama dari masing -masing gas mulia disajikan di bawah ini:
-
Helium
Energi ionisasi pertamanya adalah 2373 kJ/mol, tertinggi di seluruh tabel periodik.
-
Neon
Energi ionisasi pertamanya adalah 2080 kJ/mol dan merupakan yang tertinggi kedua.
-
Argon
Energi ionisasi pertamanya adalah 1521 kJ/mol. Hanya f, ne dan dia memiliki energi ionisasi yang lebih besar.
-
Kripton
Energi ionisasi pertama adalah 1350 kJ/mol. Ini tidak setinggi yang lain, tetapi masih lebih besar dari elemen tetangganya.
-
Xenon
Hal yang sama yang dikatakan tentang Kripton dapat dikatakan tentang Xenon dengan energi ionisasi pertama 1170 kJ/mol.
Dapat melayani Anda: Worm Hole: Sejarah, Teori, Jenis, FormasiEnergi ionisasi pertama dan kedua dari logam alkali
Logam alkali pada gilirannya memiliki energi ionisasi pertama yang paling sedikit dan energi ionisasi kedua terbesar dari semua elemen:
-
Lithium
Energi ionisasi pertamanya kurang dari seperempat dari HE, tetapi lithium memiliki energi ionisasi kedua terbesar dari semua elemen, yaitu 7300 kJ/mol.
-
Sodium
Sodium kehilangan elektron pertamanya dengan sangat mudah, karena memperoleh konfigurasi elektronik NE, tetapi untuk menghilangkan elektron kedua Anda harus memasok 4560kj/mol.
-
Kalium
Energi ionisasi kalium pertama hanya 418,7 kJ/mol, sedangkan yang kedua adalah 3052 kJ/mol, jauh lebih besar dari tetangganya.
-
Rubidium
Dengan energi ionisasi 403 kJ/mol, rubidio adalah salah satu elemen dengan energi ionisasi lebih sedikit. Namun, yang kedua adalah 2633 kJ/mol.
-
Cesium
Energi ionisasi pertamanya hanya 375 kJ/mol dan 2234 kJ/mol kedua, bahkan lebih rendah dari energi ionisasi helium pertama.

