Ikatan kovalen
- 3776
- 1133
- Herbert Fritsch
Apa itu tautan kovalen?
Ikatan kovalen adalah interaksi yang kuat yang memungkinkan dua atau lebih atom untuk bergabung untuk membentuk molekul. Ini adalah salah satu jenis ikatan kimia di mana beberapa elektron berpartisipasi yang berasal dari orbital terluar atom yang terhubung.
Secara teori, setiap atom menyumbang salah satu dari dua elektron saat menghubungkan secara kovalen, sehingga mereka memenangkan stabilitas. Sepasang elektron, yang menjadi semacam "kait elektronik" antara dua inti atom, dibagi sama antara dua atom yang identik, tetapi ini tidak terjadi ketika kedua atom tersebut terdiri dari dua elemen yang berbeda.
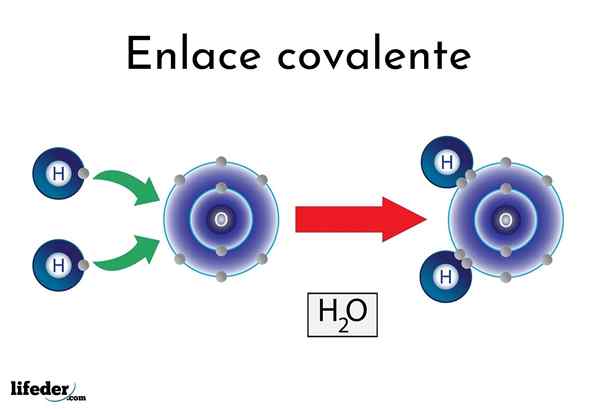
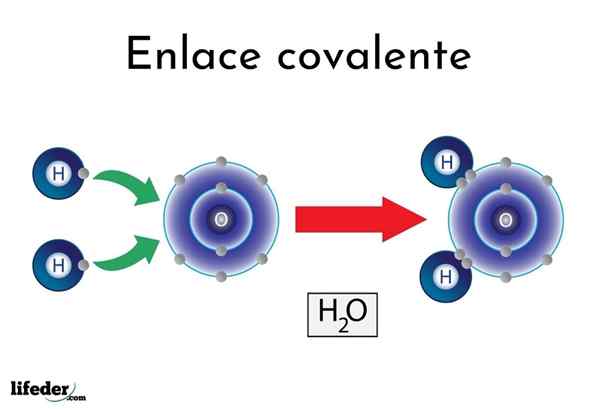 Ikatan kovalen air
Ikatan kovalen air Ada atom atau elemen yang memiliki kecenderungan alami untuk menghasilkan elektron, sementara yang lain lebih suka memenangkannya.
Misalnya, molekul air yang terkenal, h2Atau, ia memiliki dua tautan kovalen: h-o-h. Hidrogen dan oksigen berbagi dua pasang elektron, tetapi orbit ini lebih dekat ke atom oksigen daripada hidrogen. Fenomena ini disebabkan oleh polaritas dan elektronegativitas.
Karakteristik obligasi kovalen
Obligasi kovalen menyajikan karakteristik berikut:
-Mereka melibatkan beberapa elektron untuk setiap ikatan kovalen.
-Panjangnya biasanya diekspresikan dalam unit PM (picometer) atau Armstrong (Å).
-Mereka sulit untuk hancur, yang berarti mereka sangat kuat.
-Ketika mereka pecah, perubahan kimia atau transformasi terjadi, karena molekul kehilangan atom. Dalam proses ini energi diserap.
-Saat mereka terbentuk, molekul baru lahir. Dalam proses ini energi dilepaskan.
Dapat melayani Anda: reaksi kimia: karakteristik, bagian, jenis, contoh-Panjangnya bervariasi sesuai dengan aviditas yang dimiliki oleh salah satu atom terkait dengan pasangan elektron; Yaitu semakin menarik, tautan kovalen diperpanjang.
-Ikatan kovalen paling sederhana hanya ada antara dua atom pada saat yang sama, dan diwakili dengan skrip atau garis (-).
Ada fitur lain yang berlaku untuk tautan kovalen yang lebih kompleks, yang bagaimanapun juga sesuai dengan apa yang dikomentari di atas.
Jenis Tautan Kovalen
Ikatan kovalen dapat diklasifikasikan, pada prinsipnya, dalam dua cara: sesuai dengan jumlah elektron yang dibagikan, dan menurut polaritas yang dihasilkan ketika molekul terbentuk. Keduanya akan dijelaskan secara dangkal di bawah ini.
Menurut jumlah elektron bersama
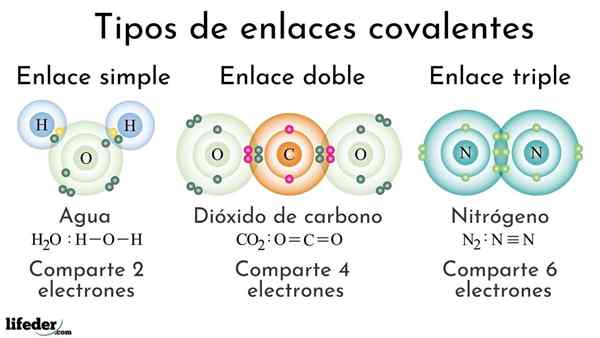 Jenis Obligasi Kovalen Menurut Jumlah Elektron Bersama
Jenis Obligasi Kovalen Menurut Jumlah Elektron Bersama Obligasi kovalen sesuai dengan jumlah elektron bersama dapat diklasifikasikan sebagai sederhana, ganda atau tiga. Pada gambar atas tautan masing -masing untuk tiga molekul yang akan dibahas di bawah ini ditampilkan.
-
Sederhana
Ikatan kovalen sederhana adalah satu di mana hanya ada beberapa elektron, yaitu dua elektron. Contoh tautan ini yang kita lihat dalam molekul air, h2SALAH SATU. Perhatikan bahwa dari semua ikatan kovalen, yang sederhana, i-i, adalah yang terpanjang dari semuanya. Ini hampir selalu.
-
Dobel
Dalam ikatan kovalen ganda yang kami miliki, seperti namanya, dua pasang elektron, yang berarti bahwa ada empat elektron yang memperkuat "kait elektronik" antara dua atom yang terhubung.
Artinya, ikatan rangkap (=) lebih kuat dari yang sederhana (-). Namun, lebih reaktif, yang meskipun mungkin tampak bertentangan, mudah dijelaskan dengan mempertimbangkan tumpang tindih orbital atom.
Dapat melayani Anda: polaritas (kimia): apa itu, definisi, contohContoh tautan ini terlihat dalam molekul karbon dioksida, CO2. Dua atom oksigen tetap sangat bersatu untuk karbon berkat ikatan ini, OR = C = O, yang, untuk menjadi lebih kuat, lebih dekat dengan atom; Dan pada gilirannya ini mengarah pada tautan yang dipersingkat.
-
Triple
Triple Link adalah ikatan kovalen terkuat dan terpendek (umum). Perhatikan bahwa untuk molekul nitrogen, n2 atau n≡N, atomnya diwakili oleh bola kebiruan sangat dekat satu sama lain.
Di triple link kami memiliki tiga pasangan elektron, yang sama dengan enam elektron yang memperkuat ikatan kovalen antara kedua atom.
-
Datif
Tautan dative adalah jenis tautan sederhana khusus yang terdiri dari sepasang elektron hanya berasal dari salah satu dari dua atom yang terhubung. Artinya, itu bisa dilihat sebagai "berbagi paksa".
Misalnya, molekul M2Atau gunakan salah satu pasangan bebas oksigen untuk menyumbangkannya ke ion h+ (H2O: → H+ = [H2OH]+ atau h3SALAH SATU+).
Menurut Polaritas
Ikatan kovalen menurut polaritas dapat diklasifikasikan sebagai kovalen kutub, atau kovalen non -polar.
-
Obligasi kovalen kutub
Itu terjadi antara dua atom berbeda yang perbedaan elektronegativitasnya besar. Ini menghasilkan pembentukan dipol, di mana atom berkonsentrasi secara negatif (menarik elektron), sedangkan yang lain berkonsentrasi secara positif (menghasilkan elektron). Misalnya, ikatan kovalen HF (H-F) adalah polar, karena fluoride lebih elektronegatif daripada hidrogen.
-
Tautan kovalen non -polar
Itu terjadi antara dua atom identik yang perbedaan elektronegativitas adalah nol atau sangat kecil. Molekul yang disebutkan di atas: i2, SALAH SATU2 dan N2 Mereka menghadirkan ikatan kovalen non -pololar. Oleh karena itu, elektron ada di sekitar kedua atom dengan frekuensi yang sama.
Itu dapat melayani Anda: uretan: struktur, sifat, mendapatkan, menggunakanContoh tautan kovalen
Akhirnya, obligasi kovalen lainnya akan terdaftar sebagai tambahan dari yang sudah dijelaskan, juga menunjukkan tipe mereka:
H2S (H-S-H), kovalen kutub sederhana | HCl (H-Cl), tautan kovalen sederhana kutub |
H2 (h-h), bukan kovalen sederhana kutub | C2H4 (H-C≡C-H), dengan dua tautan kutub sederhana (C-H) dan tautan non-polar triple (c≡C) |
F2 (F-F), kovalen non-polar sederhana | P2 (hal≡P), ikatan kovalen non -polar (atau apolar) |
Co₂ (o = c = o), kovalen kutub ganda | S2 (S = S), ikatan kovalen ganda non -polar |
HCN (H-C≡N), dengan ikatan kovalen polar sederhana (H-C), dan tautan triple polar lainnya (c≡N) | NH3 (N-H), dengan tiga ikatan kovalen kutub sederhana |
Contoh yang dikutip sesuai dengan molekul kecil. Tetapi ikatan kovalen hadir dalam semua molekul yang ada, termasuk polimer, biomolekul, makromolekul, mineral, keramik, hidrokarbon, di antara banyak lainnya.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- María Estela Raffino. (28 Juni 2020). Ikatan kovalen. Konsep.dari. Pulih dari: konsep.dari
- Wikipedia. (2020). Ikatan kovalen. Diperoleh dari: di.Wikipedia.org
- Camy Fung & Nima Mirzaee. (15 Agustus 2020). Ikatan kovalen. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (27 Agustus 2020). Apa ikatan kovalen dalam kimia? Pulih dari: thinkco.com

