Ikatan kovalen ganda

- 5065
- 913
- Frederick Pfeffer
Kami menjelaskan apa ikatan kovalen ganda, karakteristiknya dan memberikan beberapa contoh
 Molekul etilen atau etilena. Ini adalah contoh khas dari ikatan kovalen ganda antara dua atom karbon
Molekul etilen atau etilena. Ini adalah contoh khas dari ikatan kovalen ganda antara dua atom karbon Apa ikatan kovalen ganda?
Itu Obligasi kovalen ganda Mereka adalah tautan kimia di mana dua atom berbagi dua pasang elektron. Dengan kata lain, mereka adalah ikatan kovalen yang dibentuk oleh total empat elektron valensi yang berputar di sekitar dua atom.
Tautan ganda sangat umum pada senyawa organik. Misalnya, semua alkena memiliki ikatan karbon-karbon ganda. Banyak kelompok fungsional lain seperti aldehida, keton, asam karboksilat dan amida juga memiliki ikatan kovalen ganda antara karbon dan oksigen. Lainnya, seperti imine memiliki ikatan kovalen ganda c = n.
Tautan ganda memiliki banyak karakteristik yang membedakannya dari jenis ikatan kovalen lainnya seperti tautan sederhana dan tautan triple. Mereka berbeda dalam bentuk molekul yang mengandungnya, dalam gaya panjang dan tautan dan karakteristik lain yang terkait dengan sifat kimianya.
Karakteristik tautan kovalen ganda
Mereka dibentuk oleh 4 elektron
Alasan mengapa ikatan rangkap adalah karena mengandung elektron ganda dari ikatan kovalen sederhana, yang terbentuk ketika dua atom berbagi dua elektron valensi. Ini berarti bahwa setiap ikatan rangkap berisi 4 elektron.
Mereka dibentuk oleh tautan sigma (σ) dan tautan pi (π)
Dari 4 elektron yang membentuk ikatan rangkap, 2 dari mereka akan pergi dan datang antara satu atom dan yang lain, melewati pusat keduanya. Pasangan elektron ini disebut elektron sigma, karena mereka membentuk ikatan sigma (σ).
Sepasang elektron lainnya melayang di atas dan di bawah dua atom membuat semacam sandwich. Elektron ini disebut elektron pi dan membentuk tautan pi (π).
Dapat melayani Anda: chlorobenzene (c6h5cl)Bersama -sama, tautan sigma dan tautan PI membentuk ikatan kovalen ganda.
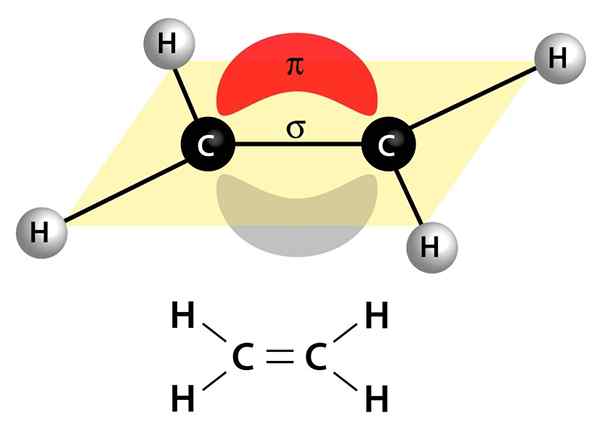 Gambar ini menunjukkan dua tautan yang membentuk ikatan rangkap: tautan PI yang muncul sebagai awan merah dan abu -abu yang ada di atas dan di bawah molekul, dan tautan sigma yang merupakan garis yang bergabung dengan kedua inti melalui tengah
Gambar ini menunjukkan dua tautan yang membentuk ikatan rangkap: tautan PI yang muncul sebagai awan merah dan abu -abu yang ada di atas dan di bawah molekul, dan tautan sigma yang merupakan garis yang bergabung dengan kedua inti melalui tengah Mereka bisa menjadi polar atau apolar
Bergantung pada elektronegativitas atom yang disatukan dengan ikatan kovalen ganda, itu bisa polar atau apolar.
Misalnya, ikatan kovalen ganda C = c Ini akan menjadi tautan apolar, karena kedua atomnya sama dan memiliki elektronegativitas yang sama. Sebaliknya, ikatan kovalen ganda C = O Itu akan menjadi polar, karena oksigen jauh lebih elektronegatif daripada karbon.
Mereka lebih kuat dari tautan sederhana
Melanggar ikatan rangkap lebih sulit daripada memecahkan hubungan sederhana antara dua atom yang sama. Ini karena, untuk memecahkan ikatan rangkap, baik tautan sigma (yang sama dengan tautan sederhana) dan tautan PI harus rusak. Karena dua tautan harus rusak, bukan satu, ikatan rangkap lebih kuat dari yang sederhana.
Mereka lebih lemah dari triple link
Dibandingkan dengan triple link, ikatan rangkap lebih lemah dan lebih mudah untuk rusak. Alasannya sama seperti sebelumnya, hanya itu, dalam hal ini, ikatan rangkap memiliki lebih sedikit tautan daripada melanggar dibandingkan dengan triple link.
Mereka lebih pendek dari tautan sederhana
Menjadi tautan yang lebih kuat daripada tautan sederhana, ikatan rangkap dapat membawa atom -atom tertaut lebih dekat daripada tautan sederhana daripada tautan sederhana. Untuk alasan ini, jika tautan C = C double dibandingkan dengan tautan C-C sederhana, yang pertama selalu lebih pendek dari yang kedua.
Dapat melayani Anda: natrium tiosulfat (na2s2o3)Mereka lebih panjang dari triple link
Sekali lagi, ketika triple link lebih kuat dari tautan ganda, tautan triple lebih pendek. Ini menyiratkan bahwa ikatan kovalen ganda lebih panjang dari tiga kali lipat.
Mereka adalah tautan yang kaku.
Ikatan kovalen sederhana cukup fleksibel dan juga dapat berputar. Di sisi lain, ikatan rangkap kaku, mereka tidak fleksibel dan tidak dapat diputar, karena tautan PI yang disebutkan di atas akan rusak.
Mereka mewakili tidak jenuh
Molekul yang memiliki ikatan rangkap akan memiliki dua atom hidrogen yang kurang terkait dari yang bisa dimiliki. Untuk alasan ini, dikatakan bahwa ikatan rangkap mewakili tidak jenuh (masing -masing tidak jenuh sesuai dengan 2 hidrogen).
Mereka membentuk molekul berbentuk segitiga datar
Atom karbon yang membentuk ikatan kovalen ganda dan dua ikatan sederhana lainnya, selalu membentuk molekul datar di mana tiga ikatan menunjuk ke ujung segitiga. Bentuk ini disebut geometri trigonal datar.
Contoh ikatan kovalen ganda
Tautan C = C dalam etilen
Ethylene adalah salah satu contoh paling sederhana dari ikatan kovalen ganda, dalam hal ini antara dua atom karbon.
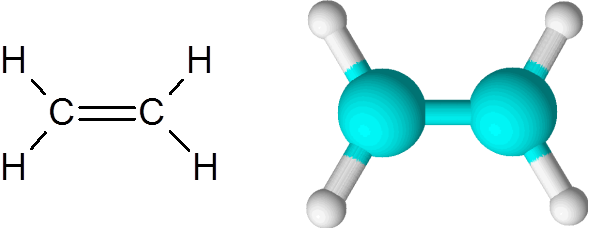 Molekul etilen
Molekul etilen Molekulnya benar -benar datar dan tidak mungkin untuk memutar tautan ke segala arah. Ikatan rangkap ini benar -benar apolar, karena menghubungkan dua atom yang sama.
Tautan c = o dalam aseton
Semua keton mengandung kelompok karbonil, yang terdiri dari atom karbon dan atom oksigen yang disatukan dengan menggunakan ikatan kovalen ganda.
Dapat melayani Anda: apa itu kinetika kimia?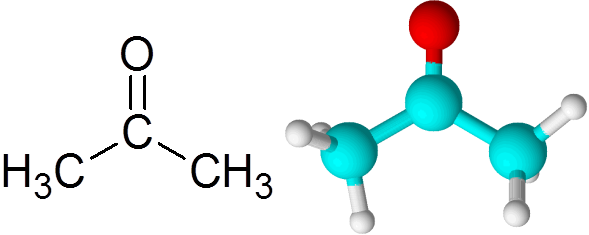 Molekul aseton
Molekul aseton Setiap atom menyumbangkan dua elektron yang hilang untuk membentuk tautan PI dan sigma yang membentuk ikatan rangkap. Sebagian besar reaksi kimia yang terjadi pada keton disebabkan oleh ikatan rangkap C = O.
Tautan o = atau dalam molekul ozon (atau3)
Dalam hal ini, atom oksigen sentral terkait dengan dua atom oksigen lainnya. Salah satu dari dua ikatan dibentuk oleh 4 elektron, sehingga sesuai dengan ikatan kovalen ganda. Tiga atom dan beberapa elektron tanpa berbagi yang memiliki atom oksigen sentral semuanya berada di bidang yang sama dari layar yang menunjuk ke sudut -sudut segitiga.
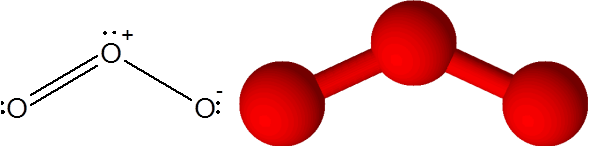 Molekul ozon
Molekul ozon Ozon memiliki kekhasan bahwa ikatan rangkap dapat "melompat" dari salah satu oksigen terminal ke yang lain. Bahkan, dia melakukannya dengan sangat cepat melalui proses yang disebut resonansi.
C = C tautan di butadieno (c4H6)
Butadieno adalah contoh senyawa organik yang memiliki dua ikatan kovalen ganda c = c.
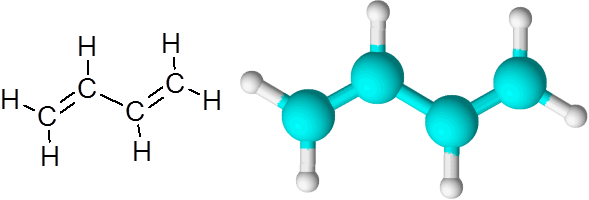 Molekul 1.3-butadiena
Molekul 1.3-butadiena Ketika obligasi rangkap dengan cara ini, dipisahkan oleh satu tautan sederhana, dikatakan bahwa mereka dikonjugasikan tautan ganda.

