Ikatan kovalen non -polar
- 2586
- 243
- Joseph Nader PhD
Kami menjelaskan apa ikatan kovalen non -pololar, karakteristiknya dan beberapa contoh
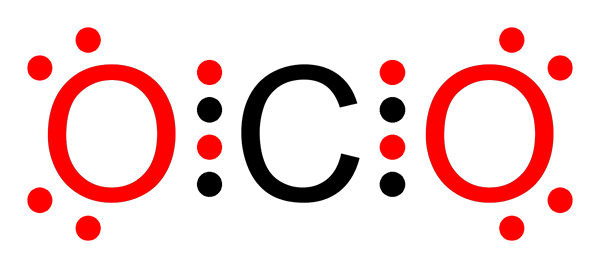
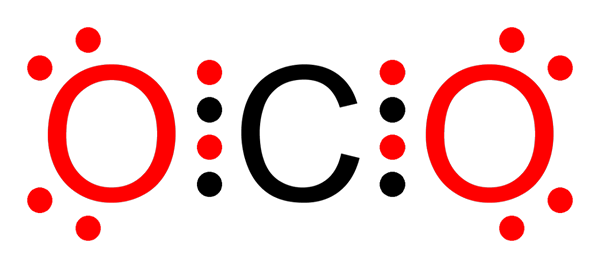 Ikatan kovalen non -polar dari karbon dioksida
Ikatan kovalen non -polar dari karbon dioksida Apa ikatan kovalen non -pololar?
A ikatan kovalen non -polar, Juga disebut ikatan kovalen murni atau apolar, itu adalah penyatuan dua atom yang berbagi satu atau lebih pasangan elektron secara setara. Dengan kata lain.
Jenis tautan ini adalah antara dua atom yang sama (dari elemen yang sama) atau antara dua atom yang berbeda, tetapi itu memiliki elektronegativitas yang sangat mirip.
Ada tiga jenis tautan kimia yang menyatukan atom satu sama lain. Ini adalah: ikatan ionik, ikatan kovalen dan tautan logam. Tautan ini berbeda menurut bagaimana elektron didistribusikan di sekitar atom.
Dalam kasus ikatan kovalen, kedua atom berbagi elektron valensi, yang berarti bahwa elektron -elektron ini, bukannya berputar di sekitar atom, berputar di sekitar keduanya. Namun, ini tidak selalu adil, karena elektron lebih suka menghabiskan lebih banyak waktu di dekat atom paling elektronegatif, sehingga menimbulkan ikatan kovalen kutub.
Dalam kasus ikatan kovalen non -pololar ini tidak terjadi, karena kedua atom memiliki elektronegativitas yang sama atau elektronegativitas yang sangat mirip.
Karakteristik Tautan Kovalen Non -Polar
1. Mereka terbentuk di antara atom dengan elektronegativitas yang sama atau sangat mirip
Mereka adalah tautan kovalen yang terbentuk antara atom yang sama atau yang memiliki elektronegativitas yang sangat mirip. Secara umum, ikatan kovalen dianggap tidak polar jika perbedaan elektronegatifitas kurang dari atau sama dengan 0,4.
Dapat melayani Anda: asam suksinat: struktur, sifat, mendapatkan, menggunakan2. Mereka bisa sederhana, ganda atau tiga kali lipat
Tergantung pada jumlah pasangan elektron yang dimiliki kedua atom, ikatan kovalen non -polar atau apolar bisa sederhana, ganda atau tiga.
Ketika ikatan dibentuk oleh sepasang elektron tunggal, itu disebut tautan sederhana, ketika dua pasangan elektron dibagi, itu disebut ikatan rangkap, dan jika tiga pasangan elektron dibagi, itu disebut triple link.
3. Mereka hampir selalu melibatkan non -logam
Logam adalah elemen dengan elektronegativitas yang sangat rendah yang membentuk tautan logam satu sama lain. Saat terhubung ke non -logam, mereka selalu membentuk ikatan ionik atau tautan kutub. Untuk alasan ini, ikatan kovalen non -pololar hanya terbentuk antara elemen non -metalik seperti hidrogen dan karbon.
4. Mereka menimbulkan senyawa apolar
Senyawa yang hanya memiliki ikatan kovalen non -pololar akan dibentuk oleh molekul apolar. Jenis senyawa ini ditandai dengan memiliki titik mendidih dan fusi yang rendah dibandingkan dengan logam dan senyawa ionik (beberapa bahkan gas pada suhu kamar), mereka tidak larut dalam air dan merupakan konduktor panas dan listrik yang buruk.
5. Mereka dapat membentuk senyawa padat, cair atau gas pada suhu kamar
Senyawa dengan ikatan kovalen non -pololar dapat memiliki titik mendidih dan fusi yang rendah tetapi sangat bervariasi.
Karena itu, beberapa dari mereka adalah gas pada suhu kamar (seperti hidrogen, h2, dan nitrogen, n2), yang lain adalah cairan (seperti Bromo, BR2), sementara yang lain solid (seperti naphthalene, c10H8).
6. Mereka memiliki energi penghubung yang relatif rendah.
Dibandingkan dengan tautan ionik, ikatan kovalen non -pololar lebih mudah pecah, karena mereka memiliki energi tautan yang lebih rendah. Ini berarti Anda harus menggunakan lebih sedikit energi untuk memecahkan ikatan kovalen non -pololar daripada ikatan ionik.
Dapat melayani Anda: hukum stoikiometriContoh Tautan Kovalen Non -Polar
Tautan H-H dalam molekul hidrogen (h2)
Dalam molekul hidrogen, h2, Dua atom hidrogen berbagi satu -satunya elektron valensi untuk membentuk ikatan kovalen sederhana.
 Molekul hidrogen
Molekul hidrogen Karena kedua atomnya sama, perbedaan elektronegativitas antara keduanya akan menjadi nol, jadi tautan ini adalah ikatan kovalen non -polar.
Tautan f-f dalam molekul fluor (f2)
Contoh ini menyoroti fakta bahwa tidak masalah elektronegativitas atom, tetapi perbedaan dalam elektronegativitas dari dua atom yang membentuk tautan untuk mengetahui apakah tautannya akan menjadi kovalen bukan polar atau tidak.
 Molekul fluor
Molekul fluor Fluor adalah elemen paling elektronegatif dari tabel periodik, sehingga cenderung menghilangkan elektronnya dari elemen lain untuk membentuk ikatan polar atau ionik.
Namun, ketika atom fluoride terkait dengan yang lain sama dengannya, tidak ada yang dapat menghilangkan elektron dari yang lain (tidak ada perbedaan dalam elektronegativitas), sehingga mereka tidak punya pilihan selain membaginya secara adil dan membentuk, dengan demikian, bentuknya, a tautan kovalen non -polar.
O-o tautan dalam molekul ozon (atau3)
Seperti dalam kasus molekul fluor, oksigen juga merupakan elemen yang sangat elektronegatif. Namun, dengan membentuk tautan dengan atom oksigen lainnya, ia membentuk ikatan kovalen non -polar. Begitulah kasus molekul ozon.
 Molekul ozon
Molekul ozon Dalam hal ini, atom oksigen sentral terkait dengan dua atom oksigen lainnya dengan menggunakan ikatan kovalen non -pololar atau apolar.
Dapat melayani Anda: magnesium oksida: struktur, sifat, nomenklatur, penggunaanTautan N-N dalam molekul nitrogen (n2)
Molekul nitrogen mengandung ikatan kovalen non -pololar, di mana masing -masing atom nitrogen berbagi tiga elektron valensi menghilang dengan yang lain.
 Molekul nitrogen
Molekul nitrogen Untuk alasan ini, kedua atom berbagi total tiga pasang elektron, sehingga membentuk ikatan kovalen tiga kali lipat.
Tautan C-H dalam molekul metana (CH4)
Metana adalah contoh ikatan kovalen non -polar yang terbentuk antara atom dari berbagai elemen, dalam hal ini, karbon dan hidrogen.
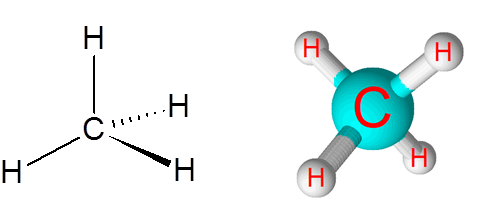 Molekul metana
Molekul metana Perbedaan elektronegativitas antara kedua elemen adalah 0,4 yang menempatkan perbatasan ini hanya antara ikatan non -polar dan polar.
Tautan C = C dalam molekul etilen (c2H4)
Molekul etilen, juga disebut eteno, memiliki total lima tautan. Empat tautan C-H dan ikatan rangkap C = C. Dalam kedua kasus, tautan sesuai dengan ikatan kovalen non -polar atau apolar.
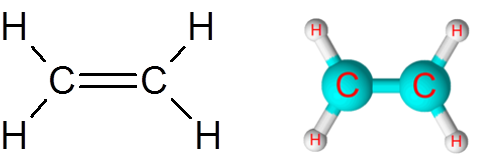 Molekul etilen
Molekul etilen
- « 6 tarian dan tarian khas Quintana roo lebih terkenal
- 9 tarian dan tarian khas Michoacán lebih terkenal »

