Karakteristik tautan ionik, bagaimana bentuk dan contoh

- 3588
- 254
- Leland Robel
Dia tautan ionik Ini adalah jenis ikatan kimia di mana ada daya tarik elektrostatik antara ion dengan beban yang berlawanan. Yaitu, ion yang dimuat secara positif membentuk tautan dengan ion yang dimuat secara negatif, mentransfer elektron dari satu atom ke atom lainnya.
Jenis ikatan kimia ini terjadi ketika elektron valensi satu atom secara permanen dipindahkan ke yang lain. Atom yang kehilangan elektron menjadi kation (dimuat secara positif), dan orang yang mendapatkan elektron menjadi anion (dimuat secara negatif).
 Contoh ikatan ionik: natrium fluoride. Sodium kehilangan elektron valencia dan memberikannya ke fluoride. WDCF [CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)]
Contoh ikatan ionik: natrium fluoride. Sodium kehilangan elektron valencia dan memberikannya ke fluoride. WDCF [CC BYS-S (https: // CreationCommons.Org/lisensi/by-sa/3.0)] [TOC]
Konsep tautan ionik
Ikatan ionik adalah bahwa di mana partikel bermuatan listrik, yang disebut ion, berinteraksi untuk menimbulkan padatan dan cairan ionik. Tautan ini adalah produk dari interaksi elektrostatik antara ratusan juta ion, dan tidak terbatas hanya untuk beberapa dari mereka; Artinya, itu melampaui daya tarik antara beban positif menuju beban negatif.
Pertimbangkan misalnya senyawa ionik natrium klorida, NaCl, dikenal sebagai garam meja. Di NaCl, ikatan ionik mendominasi, sehingga terdiri dari ion Na+ dan Cl-. Na+ Itu adalah ion atau kation positif, sedangkan CL- (Klorida) adalah ion atau anion negatif.
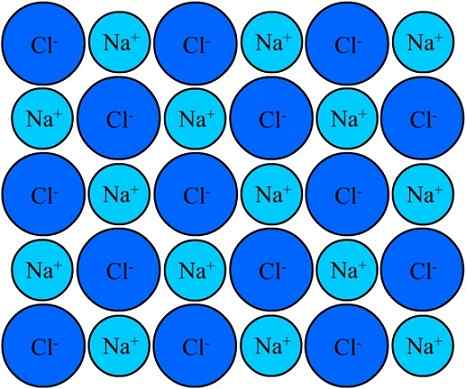 Ion Na+ dan Cl-in dalam natrium klorida tetap bersatu berkat ikatan ionik. Sumber: Eyal Bairey via Wikipedia.
Ion Na+ dan Cl-in dalam natrium klorida tetap bersatu berkat ikatan ionik. Sumber: Eyal Bairey via Wikipedia. Keduanya na+ Seperti cl- Mereka tertarik untuk menjadi muatan listrik yang berlawanan. Jarak antara ion -ion ini memungkinkan orang lain untuk mendekati, sehingga pasangan dan pasangan NaCl muncul. Kation na+ Mereka akan mengusir satu sama lain karena memiliki beban yang sama, dan hal yang sama terjadi satu sama lain dengan anion CL-.
Ada saatnya jutaan ion na+ dan Cl- Mereka berhasil menyatukan, kohesif, untuk berasal dari struktur setegar mungkin; Yang diatur oleh tautan ionik (gambar superior). Kation na+ Mereka lebih kecil dari anion CL- Karena kekuatan nuklir yang efektif dari nukleusnya pada elektron eksternal.
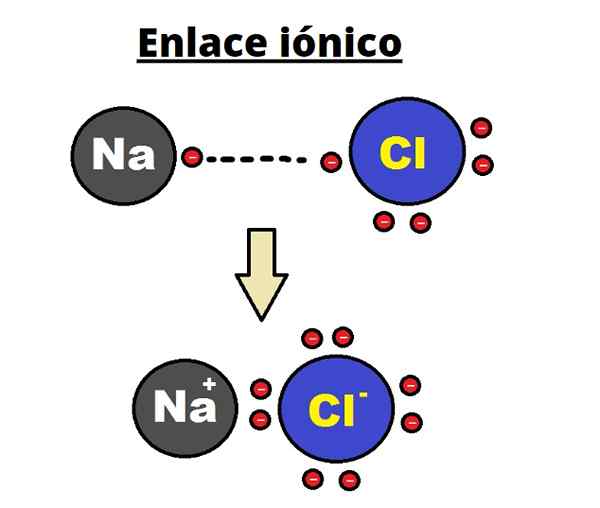 Tautan Ionik NaCl. RHANNOSH/CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/3.0)
Tautan Ionik NaCl. RHANNOSH/CC BY-SA (https: // CreationCommons.Org/lisensi/by-sa/3.0) Ikatan ionik ditandai dengan membangun struktur yang dipesan di mana jarak antara ion (NA+ dan Cl- Dalam kasus NaCl) kecil dibandingkan dengan padatan lainnya. Ada pembicaraan tentang struktur kristal ionik.
Bagaimana tautan ionik?
Ikatan ionik hanya terjadi jika distribusi elektron terjadi sehingga beban ion muncul. Jenis tautan ini tidak akan pernah terjadi di antara partikel netral. Pasti ada kation dan anion. Tapi dari mana mereka berasal?
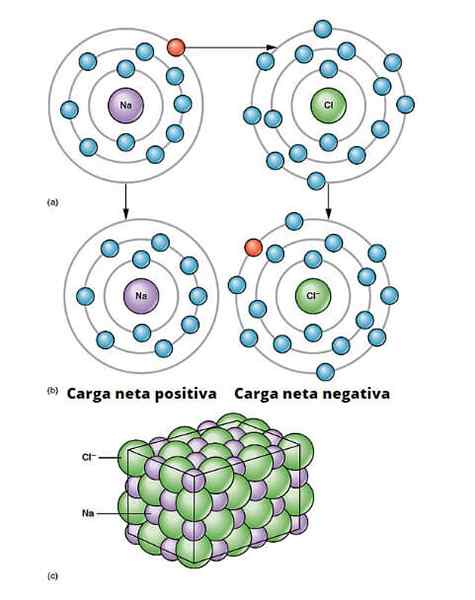 Ilustrasi tautan ionik. A) Sodium memiliki beban bersih negatif. b) Sodium memberikan elektron ke klorin. Sodium dengan beban bersih positif dan klorin dengan beban bersih negatif, menghasilkan ikatan ionik. Jenis hubungan antara jutaan atom Na dan CL ini menimbulkan garam fisik. OpenX College/CC oleh (https: // createveCommons.Org/lisensi/oleh/3.0)
Ilustrasi tautan ionik. A) Sodium memiliki beban bersih negatif. b) Sodium memberikan elektron ke klorin. Sodium dengan beban bersih positif dan klorin dengan beban bersih negatif, menghasilkan ikatan ionik. Jenis hubungan antara jutaan atom Na dan CL ini menimbulkan garam fisik. OpenX College/CC oleh (https: // createveCommons.Org/lisensi/oleh/3.0) Ada banyak cara yang berasal dari ion, tetapi pada dasarnya banyak yang didasarkan pada reaksi reduksi oksidasi. Sebagian besar senyawa ionik anorganik terdiri dari elemen logam dengan elemen non -metalik (yang dari blok P dari tabel periodik).
Logam harus teroksidasi, kehilangan elektron, untuk berubah menjadi kation. Di sisi lain, elemen non -metalik berkurang, memperoleh elektron ini, dan menjadi anion. Gambar berikut menggambarkan poin ini untuk pembentukan NaCl dari atom natrium dan klorin:
Dapat melayani Anda: asam arsenat (H3SO4): sifat, risiko dan penggunaan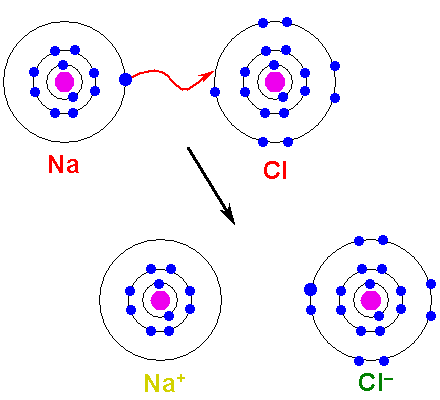 Pembentukan tautan ionik. Sumber: Shafei at Arab Wikipedia / Domain Publik
Pembentukan tautan ionik. Sumber: Shafei at Arab Wikipedia / Domain Publik Atom Na menyumbangkan salah satu elektron Valencia ke CL. Ketika distribusi elektron ini terjadi, ion Na terbentuk+ dan Cl-, yang mulai menarik segera dan secara elektrostatis.
Oleh karena itu dikatakan bahwa na+ dan Cl- Mereka tidak berbagi sepasang elektron apa pun, tidak seperti apa yang bisa diharapkan untuk ikatan kovalen NA-Cl hipotetis.
Properti tautan ionik
Ikatan ionik adalah non -langsung, yaitu kekuatannya tidak ada dalam satu arah, tetapi disebarkan oleh ruang berdasarkan jarak yang memisahkan ion. Fakta ini penting, karena itu berarti ion sangat bersatu, yang menjelaskan beberapa sifat fisik padatan ionik.
Titik lebur
Ikatan ionik bertanggung jawab untuk garam hingga suhu 801 ºC. Suhu ini sangat tinggi dibandingkan dengan titik fusi beberapa logam.
Ini karena NaCl harus menyerap panas yang cukup sehingga ion -ionnya mulai mengalir dengan bebas di luar kristal mereka; Artinya, atraksi antara NA harus diatasi+ dan Cl-.
Titik didih
Titik fusi dan didih dari senyawa ionik adalah produk yang sangat tinggi dari interaksi elektrostatik yang kuat: ikatan ionik mereka. Namun, karena tautan ini melibatkan banyak ion, perilaku ini biasanya diberikan kepada kekuatan antar molekul, dan tidak dengan benar untuk ikatan ionik.
Dalam kasus garam, setelah NaCl dilelehkan, cairan yang terdiri dari ion awal yang sama diperoleh; Hanya sekarang mereka bergerak dengan kebebasan yang lebih besar. Tautan ionik masih ada. Ion na+ dan Cl- Mereka bertemu di permukaan cairan untuk menciptakan ketegangan permukaan yang hebat, yang mencegah ion melarikan diri dari fase gas.
Oleh karena itu, garam cair selanjutnya harus meningkatkan suhunya sampai mendidih. Titik didih NaCl adalah 1465 ºC. Pada suhu ini panas melebihi atraksi antara NA+ dan Cl- Dalam cairan, jadi uap NaCl mulai terbentuk dengan tekanan yang sama dengan atmosfer.
Elektronegativitas
Sebelumnya dikatakan bahwa ikatan ionik terbentuk antara elemen logam dan elemen non -metalik. Singkatnya akun: antara logam dan non -logam. Biasanya ini dalam hal senyawa ion anorganik; Yang terpenting, tipe biner, seperti NaCl.
Untuk distribusi elektron (NA+Cl-) dan bukan berbagi (NA-Cl), harus ada perbedaan elektronegativitas yang besar antara kedua atom. Kalau tidak, tidak akan ada hubungan ionik di antara mereka berdua. Mungkin pendekatan NA dan CL, berinteraksi, tetapi segera CL, untuk elektronegativitas yang lebih besar, "merebut" elektron ke NA.
Namun, skenario ini hanya berlaku untuk senyawa biner, MX, seperti NaCl. Untuk garam lain atau senyawa ionik, proses pelatihan mereka lebih rumit dan tidak dapat ditangani dari perspektif atom atau molekuler sekadar.
Itu bisa melayani Anda: alquinosTeman-teman
Tidak ada jenis ikatan ionik yang berbeda, karena fenomena elektrostatik murni fisik, hanya memvariasikan cara di mana ion berinteraksi, atau jumlah atom yang mereka miliki; yaitu, jika mereka adalah ion monoatomik atau poliiatomik. Juga, setiap elemen atau senyawa menyebabkan ion karakteristik yang mendefinisikan sifat senyawa.
Di bagian Contoh, poin ini akan diperdalam, dan akan terlihat bahwa tautan ionik pada dasarnya sama di semua senyawa. Ketika ini tidak terpenuhi, dikatakan bahwa ikatan ionik memiliki karakter kovalen tertentu, yang merupakan kasus dari banyak logam transisi, di mana anion dikoordinasikan dengan kation; Misalnya, FECL3 (Keyakinan3+-Cl-).
Contoh tautan ionik
Beberapa senyawa ionik akan tercantum di bawah ini, dan ion serta proporsinya akan disorot:
- Magnesium klorida
Mgcl2, (Mg2+Cl-), Dalam proporsi 1: 2 (mg2+: 2 Cl-)
- Kalium fluoride
KF, (k+F-), Dalam proporsi 1: 1 (k+: F-)
- Sodium sulfida
Na2S, (na+S2-), Dalam proporsi 2: 1 (2nd+: S2-)
- Lito Hydroxide
Lioh, (Li+Oh-), Dalam proporsi 1: 1 (li+: Oh-)
- Kalsium fluoride
Kaf2, (AC2+F-), Dalam proporsi 1: 2 (CA2+: 2f-)
- Sodium karbonat
Na2BERSAMA3, (Na+BERSAMA32-), Dalam proporsi 2: 1 (2nd+: Co32-)
- Kalsium karbonat
Maling3, (AC2+BERSAMA32-), Dalam proporsi 1: 1 (CA2+: Co32-)
- Kalium permanganat
Kmno4, (K+Mne4-), Dalam proporsi 1: 1 (k+: M N4-)
- Tembaga sulfat
Cuso4, (Cu2+Sw42-), Dalam proporsi 1: 1 (Cu2+: JADI42-)
- Barium hidroksida
Ba (oh)2, (BA2+Oh-), Dalam proporsi 1: 2 (BA2+: Oh-)
- Aluminium bromida
Alb3, (Ke3+Br-), dalam proporsi 1: 3 (ke3+: 3BR-)
- Besi oksida (III)
Keyakinan2SALAH SATU3, (Keyakinan3+SALAH SATU2-), Dalam proporsi 2: 3 (2fe3+: 32-)
- Strontium oksida
SRO, (SR2+SALAH SATU2-), Dalam proporsi 1: 1 (SR2+: SALAH SATU2-)
- Perak klorida
Agcl, (AG+Cl-), Dalam proporsi 1: 1 (AG+: Cl-)
- Yang lain
-Ch3CONA, (Pilih3Mendekut-Na+), Dalam proporsi 1: 1 (cho3Mendekut-: Na+)
- NH4I, (NH4+yo-), Dalam proporsi 1: 1 (NH4+: YO-)
Masing -masing senyawa ini menyajikan ikatan ionik di mana jutaan ion, sesuai dengan formula kimianya, tertarik secara elektrostatis dan berasal dari padatan. Semakin besar besarnya beban ioniknya, semakin kuat atraksi dan penolakan elektrostatik.
Oleh karena itu, ikatan ionik cenderung lebih kuat semakin besar muatan ion yang membentuk senyawa.
Dapat melayani Anda: alkenaLatihan terpecahkan
Beberapa latihan yang menempatkan pengetahuan dasar dari tautan ionik akan diselesaikan di bawah ini.
- Latihan 1
Manakah dari senyawa berikut ini yang ionik? Pilihannya adalah: hf, h2Atau, nah, h2S, NH3 dan mgo.
Senyawa ionik harus memiliki ikatan ionik menurut definisi. Semakin besar perbedaan elektronegativitas di antara elemen komponennya, semakin besar karakter ionik dari tautan tersebut.
Oleh karena itu, opsi yang tidak memiliki elemen logam dibuang pada prinsipnya: hf, h2Atau, h2S dan NH3. Semua senyawa ini hanya dibentuk oleh elemen non -metal. Kation nh4+ Ini adalah pengecualian untuk aturan ini, karena tidak memiliki logam.
Pilihan yang tersisa adalah Nah dan MgO, yang masing -masing memiliki logam Na dan Mg, disatukan dengan elemen non -metalik. Nah (na+H-) dan mgo (mg2+SALAH SATU2-) Mereka adalah senyawa ionik.
- Latihan 2
Pertimbangkan senyawa hipotetis berikut: AG (NH4)2BERSAMA3yo. Apa ion Anda dan dalam proporsi apa di dalam padatan?
Mengurai senyawa pada ion mereka yang kita miliki: AG+, NH4+, BERSAMA32- dan saya-. Ini bergabung secara elektrostatis mengikuti proporsi 1: 2: 1: 1 (AG+: 2nh4+: Co32-: YO-). Berarti jumlah kation nh4+ Itu dua kali lipat untuk ion ag+, BERSAMA32- dan saya-.
- Latihan 3
Manakah dari senyawa berikut yang akan diharapkan pada prinsipnya bahwa tautan ionik terkuat? Pilihannya adalah: KBR, CAS, NA2Sw4, Cuo, alpo4 dan pb3P4.
KBR terdiri dari ion k+ dan br-, Dengan banyak beban. Kemudian, CAS memiliki ion CA2+ dan S2-, Dengan beban magnitudo ganda, sehingga bisa dianggap bahwa tautan ionik di CAS lebih kuat daripada di KBR; Dan juga lebih kuat dari pada na2Sw4, karena yang terakhir terdiri dari ion Na+ Dan sebagainya42-.
Baik Cas dan Cuo mungkin memiliki tautan ionik yang sama, karena keduanya mengandung ion dengan beban magnitudo ganda. Lalu kami memiliki alpo4, dengan ion al3+ dan po43-. Ion -ion ini memiliki beban besar tiga, jadi tautan ionik di ALPO4 Itu harus lebih kuat dari pada semua opsi di atas.
Dan akhirnya, kami memiliki pemenang PB3P4, Nah, jika kita berasumsi bahwa itu dibentuk oleh ion, mereka menjadi PB4+ Dan p3-. Beban mereka memiliki besaran terbesar; Dan karena itu, PB3P4 Itu adalah senyawa yang mungkin memiliki ikatan ionik terkuat.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Wikipedia. (2020). Ikatan ion. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 Februari 2020). Ionic vs Covalent Bonds - Memahami perbedaannya. Pulih dari: thinkco.com
- Para editor Eeritlopaedia Britannica. (31 Januari 2020). Ikatan ion. Encyclopædia Britannica. Dipulihkan dari: Britannica.com
- Kamus Chemicool. (2017). Definisi ikatan ionik. Pulih dari: chemicool.com
- « Fitur keseimbangan granrataria, bagian dan cara menggunakannya
- Model Atom Rutherford History Atomic, Eksperimen, Departemen »

