Tautan pi
- 2936
- 658
- Mr. Darrell Streich
Kami menjelaskan apa tautan PI, bagaimana karakteristiknya terbentuk, dan kami memberikan beberapa contoh
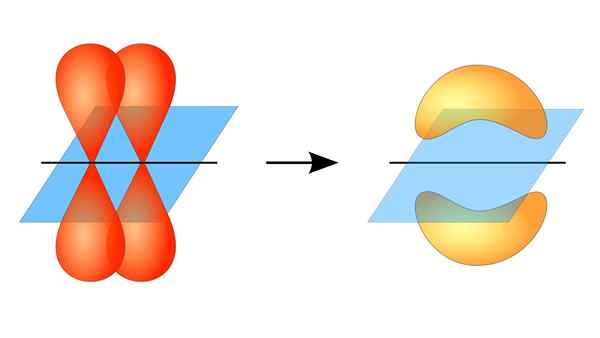
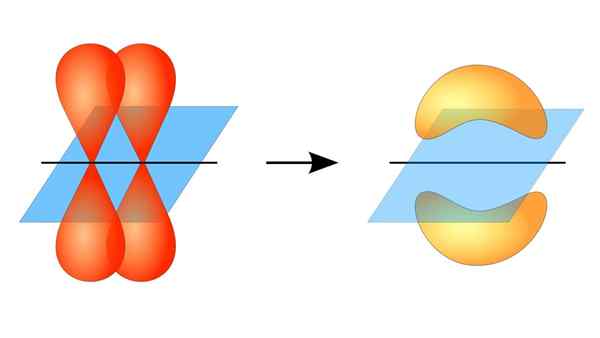 Dua orbital p membentuk tautan π
Dua orbital p membentuk tautan π Apa itu tautan pi?
A Tautan pi (π) Ini adalah jenis kovalen dari tautan yang ditandai dengan mencegah gerakan rotasi bebas atom dan berasal antara sepasang orbital atom murni, di antara kekhasan lainnya. Ada tautan yang dapat dibentuk antara atom oleh elektronnya, yang memungkinkan mereka membangun struktur yang lebih besar dan lebih kompleks: molekul.
Tautan ini dapat memiliki varietas yang berbeda, tetapi yang paling umum dalam bidang studi ini adalah kovalen. Ikatan kovalen, juga disebut molekuler, adalah jenis tautan di mana atom yang terlibat berbagi pasangan elektron.
Ini dapat terjadi karena kebutuhan atom untuk mencari stabilitas, sehingga membentuk sebagian besar senyawa yang diketahui. Dalam hal ini, ikatan kovalen bisa sederhana, ganda atau tiga, tergantung pada konfigurasi orbital mereka dan jumlah pasangan elektron yang dibagi antara atom yang terlibat.
Inilah sebabnya mengapa ada dua jenis ikatan kovalen yang terbentuk antara atom berdasarkan orientasi orbital mereka: tautan sigma (σ) dan tautan pi (π) (π).
Penting untuk membedakan kedua tautan, karena tautan Sigma disajikan dalam serikat pekerja sederhana dan PI dalam beberapa serikat antara atom (dua atau lebih elektron dibagikan).
Bagaimana bentuk tautan pi?
Untuk menggambarkan pembentukan tautan PI, pertama -tama harus dibahas tentang proses hibridisasi, karena mengintervensi dalam beberapa tautan penting.
Hibridisasi adalah proses di mana orbital elektronik hibrida terbentuk; yaitu, di mana orbital sub -tingkat atom dan p dapat dicampur. Ini menyebabkan pembentukan SP, SP orbital2 dan sp3, yang disebut hibrida.
Dapat melayani Anda: reaksi reversibel: karakteristik dan contohDalam hal ini, pembentukan tautan PI terjadi berkat tumpang tindih beberapa lobus milik orbital atom pada sepasang lobus lain yang ada dalam orbital yang merupakan bagian dari atom lain.
Tumpang tindih orbital ini terjadi secara lateral, sehingga distribusi elektronik terkonsentrasi sebagian besar di atas dan di bawah bidang yang membentuk inti atom terkait, dan menyebabkan ikatan PI lebih lemah daripada ikatan sigma.
Saat berbicara tentang simetri orbital dari jenis persatuan ini, harus disebutkan bahwa itu sama dengan tipe p orbital p selama diamati melalui sumbu yang dibentuk oleh tautan. Selain itu, serikat ini sebagian besar dibentuk oleh orbital p.
Pembentukan ikatan pi pada spesies kimia yang berbeda
Karena ikatan PI selalu disertai dengan satu atau dua tautan lagi (satu sigma atau pi lainnya dan satu sigma), relevan untuk mengetahui bahwa ikatan rangkap yang terbentuk antara dua atom karbon (dibentuk oleh ikatan sigma dan satu pi) memiliki energi tautan yang lebih rendah daripada yang sesuai dengan dua kali link sigma antara keduanya.
Ini dijelaskan oleh stabilitas tautan sigma, yang lebih besar dari ikatan PI karena tumpang tindih orbital atom pada yang terakhir terjadi secara paralel di daerah di atas dan di bawah lobus, mengumpulkan distribusi elektronik dengan cara atom lebih jauh dari atom nuklei.
Meskipun demikian, ketika tautan PI dan Sigma digabungkan beberapa tautan lebih keras daripada tautan sederhana dengan sendirinya, yang dapat diverifikasi dengan mengamati panjang tautan antara berbagai atom dengan tautan sederhana dan berganda.
Dapat melayani Anda: oksida non -metalikAda beberapa spesies kimia yang dipelajari dengan perilaku luar biasa, seperti senyawa koordinasi dengan elemen logam, di mana atom pusat hanya disatukan oleh ikatan pi.
Karakteristik tautan pi
Tidak mengizinkan pergerakan rotasi atom bebas
Karakteristik yang membedakan hubungan PI dari jenis interaksi lain antara spesies atom dijelaskan di bawah ini, dimulai dengan fakta bahwa persatuan ini tidak memungkinkan gerakan rotasi bebas atom, seperti karbon. Untuk alasan ini, jika ada rotasi atom, pecahnya ikatan terjadi.
Tumpang tindih antara orbital dengan dua wilayah paralel
Demikian juga, dalam hubungan ini tumpang tindih antara orbital terjadi melalui dua daerah paralel, membuatnya memiliki difusi yang lebih besar daripada ikatan sigma dan bahwa, untuk alasan ini, mereka lebih lemah.
Antara beberapa orbital atom murni
Di sisi lain, seperti yang disebutkan di atas, tautan PI selalu dihasilkan di antara sepasang orbital atom murni; Ini berarti dihasilkan di antara orbital yang belum menderita proses hibridisasi, di mana kepadatan elektron sebagian besar terkonsentrasi di atas dan di bawah bidang yang dibentuk oleh serikat kovalen.
Dalam hal ini, lebih dari satu tautan PI dapat disajikan di antara beberapa atom, selalu disertai dengan tautan sigma (dalam ikatan rangkap).

Demikian pula, Anda dapat memberikan triple link antara dua atom yang berdekatan, yang dibentuk oleh dua ikatan PI dalam posisi yang membentuk bidang tegak lurus satu sama lain dan hubungan sigma antara kedua atom tersebut.
Dapat melayani Anda: asam humat: struktur, sifat, mendapatkan, menggunakanContoh tautan pi
Molekul etilen
Seperti yang dinyatakan sebelumnya, molekul -molekul yang dibentuk oleh atom bersatu oleh satu atau lebih ikatan PI selalu memiliki banyak tautan; yaitu, ganda atau tiga.
Contohnya adalah molekul etilen (h2C = ch2), yang dibentuk oleh persatuan ganda; Yaitu, satu ikatan sigma antara atom karbonnya, selain ikatan sigma antara karbon dan hidrogen.
Molekul asetilena
Untuk bagiannya, molekul asetilena (H-C≡C-H) memiliki hubungan tiga antara atom karbonnya; yaitu, dua ikatan PI yang membentuk bidang tegak lurus dan ikatan sigma, di samping ikatan karbon-hidrogen yang sesuai.
Benzena dan turunan
Ikatan PI antara molekul siklik juga disajikan, seperti benzena (c6H6) dan turunannya, yang disposisi menghasilkan efek yang disebut resonansi, yang memungkinkan kepadatan elektronik bermigrasi antara atom dan hibah, antara lain, stabilitas yang lebih besar pada senyawa.
Dicarbon
Untuk mencontohkan pengecualian yang disebutkan sebelumnya, kasus -kasus molekul dicarbonal (C = C, di mana kedua atom memiliki sepasang elektron berpasangan) dan senyawa koordinasi yang disebut hexacarbonildihierro (diwakili sebagai iman2(BERSAMA)6, yang hanya dibentuk oleh tautan pi di antara atom -atomnya).

