Enthalpía
- 4067
- 304
- Pete Lesch
Apa entalpi?
Itu Enthalpía Ini adalah sifat termodinamika yang variasinya, di bawah kondisi suhu dan tekanan yang konstan, menentukan energi kalori suatu zat atau sistem yang terkait dengan reaksi kimia atau proses fisik. Menjadi fungsi negara, itu diwakili dengan surat di Capital H, menjadi variasinya.
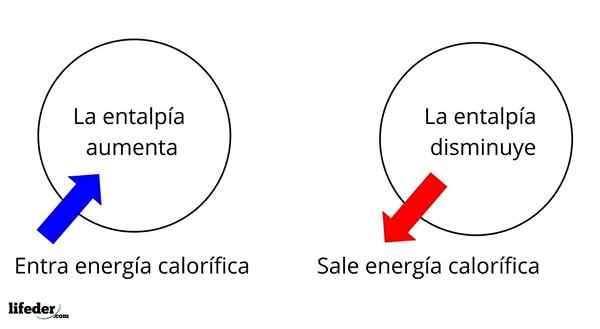
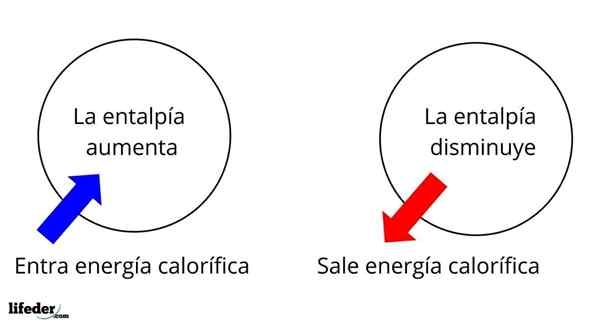
Ini adalah salah satu sifat ekstensif paling mendasar untuk mempelajari termokimia dari banyak reaksi; Artinya, kita berbicara tentang detasemen atau penyerapan panas antara media reaksi dan lingkungannya. Dengan demikian, kita mengatakan bahwa reaksi adalah eksotermik jika ΔH -nya negatif (ΔH 0).
 Perubahan entalpi dalam pencairan es adalah positif, menunjukkan bahwa es menyerap panas dari lingkungan untuk bergerak ke keadaan cair, air
Perubahan entalpi dalam pencairan es adalah positif, menunjukkan bahwa es menyerap panas dari lingkungan untuk bergerak ke keadaan cair, air Es, misalnya, memiliki entalpi, hEs, Sementara air juga memiliki entalpi sendiri, hair. Saat es meleleh, variasi entalpi terjadi, disebut ΔHFus atau panas mencair (hair-HEs). Air entalpi lebih unggul dari es, menyebabkan ΔHFus Karena es adalah positif dan memiliki nilai +6.01 kJ/mol.
Entalpi dan variasinya biasanya diekspresikan dalam unit joule atau kalori. Perubahan entalpi +6.01 kJ/mol menunjukkan bahwa mol es harus menyerap 6.01 kJ energi kalori atau panas untuk meleleh.
Bagaimana entalpia dihitung?
Entalpi dan variasinya
Entalpi itu sendiri tidak terhitung, karena tergantung pada variabel yang sulit diukur dengan tepat. Perbandingan yang baik adalah dengan ingin mengukur volume total lautan: akan selalu ada bagian -bagiannya di bawah bumi atau tersebar di antara benua. Oleh karena itu, dan dalam praktiknya, H tidak dapat ditentukan; Tapi ya ΔH.
Dapat melayani Anda: koloidUntuk mencapai ekspresi matematika yang memungkinkan perhitungan ΔH, pertama -tama harus dibiarkan dari definisi mendasar entalpi:
H = u + pv
Menjadi energi internal sistem atau zat yang dimaksud, dan PV pekerjaan volume tekanan yang diberikan sistem ini pada lingkungan yang ada. Karena kami tertarik untuk menghitung ΔH dan tidak ada h, kami memiliki:
ΔH = ΔU + δ (PV)
Jika tekanan konstan, persamaan akan tetap:
ΔH = ΔU + pΔV
Kami tahu di sisi lain itu:
ΔU = Q + W
Makhluk Q Panas dan W Bekerja. Mengganti kami:
ΔH = Q + W + PΔV
Tapi selain itu, kita tahu itu:
W = - pΔV
Dan maka dari itu:
ΔH = Q - PΔV + PΔV
ΔH = Q
Yaitu, ΔH untuk reaksi atau proses, dilakukan di bawah tekanan konstan, akan sama dengan panas Q dihasilkan atau diserap.
Reaksi perubahan entalpi
Asumsi bahwa tekanan tetap konstan dimungkinkan jika reaksi terjadi di bawah atmosfer Bumi. Misalnya, es lanskap musim dingin meleleh tanpa mengalami tekanan lain selain atmosfer kita. Di sisi lain, itu juga berlaku untuk reaksi dalam media cair, atau yang tidak menghasilkan gas dalam jumlah besar.
Reaksi ini menyerap atau melepaskan panas Q sama dengan ΔH, yang pada gilirannya, adalah perbedaan dalam entalpi antara produk dan reaktan:
ΔH = HProduk - HReaktan
Jenis entalpi
Ini adalah praktik umum untuk berbicara tentang ΔH dan h seolah -olah mereka sama: keduanya disebut entalpies. Namun, ketika datang ke jenisnya, H adalah unik untuk setiap zat atau sistem; Sementara ΔH, di sisi lain, tunduk pada sifat reaksi atau proses dalam diri mereka sendiri.
Dalam hal ini, pertama -tama kita memiliki variasi entalpi positif (ΔH> 0) atau negatif (ΔH <0); unas corresponden a los procesos o reacciones endotérmicos (se enfrían los alrededores), mientras las segundas tienen que ver con los procesos o reacciones exotérmicos (se calientan los alrededores).
Itu dapat melayani Anda: nitrobenzene (c6h5n2): struktur, sifat, penggunaan, risikoTanda '+' atau '-' yang menyertai ΔH memberi tahu kita karena itu jika ada pembebasan atau penyerapan panas dalam reaksi atau proses tertentu; yang memiliki karakteristik ΔH mereka, sebagai bagian dari sifat termokimia mereka.
Kami memiliki infinitas jenis entalpi, yang dapat diklasifikasikan menurut proses fisik atau reaksi kimia.
Proses fisik
Ubah entalpi fase
Zat perlu menyerap atau melepaskan panas untuk bergerak dari fase material atau material (padat, cair atau gas) ke yang lain. Misalnya, es menyerap panas untuk meleleh, jadi entalpi untuk perubahan fase ini sesuai dengan fusi, ΔHFus, Juga disebut panas panas laten.
Entalpi pembubaran atau campuran
Zat ketika dilarutkan atau dicampur dalam media pelarut dapat menyerap atau melepaskan panas, sehingga memiliki entalpi ΔHDis atau ΔHMencampur.
Reaksi kimia
Melatih entalpi
Itu adalah panas yang terkait, ΔHºF, ke pembentukan senyawa, khususnya satu tahi lalat, dari elemen konstituennya dalam kondisi standar tekanan dan suhu (t = 298.15 K dan p = 1 atm).
Dekomposisi entalpi
Itu adalah panas yang terkait, ΔHdes, dengan degradasi senyawa dalam zat yang lebih kecil dan sederhana. Umumnya positif, karena panas diperlukan untuk memecahkan ikatan molekul.
Entalpi hidrogenasi
Itu adalah panas yang terkait, ΔHH, Untuk kecanduan molekul hidrogen pada senyawa, biasanya hidrokarbon.
Entalpi pembakaran
Itu adalah panas yang dilepaskan, ΔHsisir, Saat zat terbakar bereaksi dengan oksigen. Itu negatif, karena panas dan cahaya dilepaskan (api).
Itu dapat melayani Anda: massa atom: definisi, tipe, cara menghitungnya, contohContoh entalpi
Akhirnya, sebutkan beberapa contoh spesifik entalpi akan dibuat:
Pembakaran metana
Ch4 + 22 → co2 + 2h2SALAH SATU
ΔH = -890.3 kJ/mol
Yaitu, satu mol cho4 Saat pembakaran membebaskan 890.3 kJ energi kalori.
Hidrogenasi etilen
Ch2= Ch2 + H2 → Ch3Ch3
ΔH = -136 kJ/mol
Lingkungan etilena melepaskan 136 kj panas saat hidrogen menjadi etana.
Garam dalam air
Garam meja, NaCl, larut dalam air untuk memisahkan ion Na+ dan Cl- jaringan kristal dan mengelilingi (hidrat) molekul air:
NaCl → NA+(Ac) + cl-(AC)
ΔH = +3.87 kJ/mol
Yaitu, melarutkan garam dalam air, sesuai untuk mendinginkan kaca atau wadah. Namun, jumlah panas yang diserap sangat kecil, jadi tangan kita hanya akan merasakan sedikit perubahan suhu.
Pembubaran kalium klorat dalam air
Di sisi lain, kalium klorat, kclo3, Itu memang memiliki ΔHDis sangat positif:
Kcl3(s) → k+(ac) + clo3-(AC)
ΔH = +41.38 kJ/mol
Yang berarti melarutkan dalam air yang diserapnya sangat panas. Dan oleh karena itu, wadah akan mendingin secara signifikan, dan kita akan melihat bahwa uap air di sekitarnya akan melembabkan permukaan luarnya.
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2020). Entalpi. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (28 Agustus 2020). Definisi entalpi dalam kimia dan fisika. Pulih dari: thinkco.com
- Andrew Rader Studios. (2015). Energi dan entalpi. Pulih dari: fisika4kids.com
- Kiddle. (2020). Fakta entalpi untuk anak -anak. Diperoleh dari: Fakta.Kiddle.bersama
- Admin. (21 Desember 2010). Entalpi. Pulih dari: bahan kimia oksiorganik.com
- María Estela Raffino. (11 Juli 2020). Konsep Entalpia. Pulih dari: konsep.dari

