Etano
- 2089
- 92
- Pete Lesch
 Struktur Estano
Struktur Estano Apa itu Ethane?
Dia Etano Ini adalah hidrokarbon Formula C sederhana2H6 Dengan sifat gas toilet yang tidak berwarna dan toilet yang memiliki penggunaan yang sangat berharga dan beragam dalam sintesis etilen. Selain itu, ini adalah salah satu gas tanah yang juga telah terdeteksi di planet lain dan badan bintang di sekitar tata surya. Itu ditemukan oleh ilmuwan Michael Faraday pada tahun 1834.
Di antara sejumlah besar senyawa organik yang dibentuk oleh atom karbon dan hidrogen (dikenal sebagai hidrokarbon), ada yang dalam keadaan gas pada suhu dan tekanan lingkungan, yang sangat digunakan di berbagai industri.
Ini biasanya berasal dari campuran gas yang disebut "gas alam", produk bernilai tinggi untuk kemanusiaan, dan membentuk metana, etana, propana dan tipe butana, antara lain; memenuhi syarat sesuai dengan jumlah atom karbon dalam rantainya.
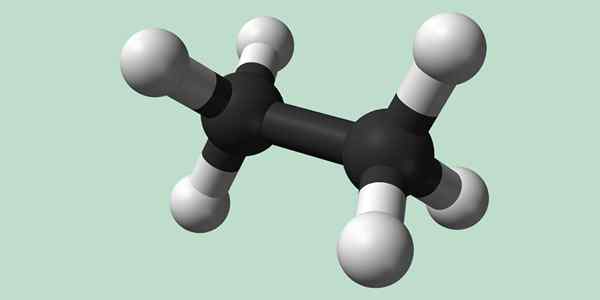
Struktur kimia etana
Estano adalah molekul formula C2H6, biasanya dilihat sebagai penyatuan dua kelompok metil (-ch3) Untuk membentuk hidrokarbon dari ikatan karbon-karbon sederhana. Ini juga merupakan senyawa organik paling sederhana setelah metana, mewakili dirinya sendiri:
H3C-ch3
Atom karbon dalam molekul ini memiliki hibridisasi tipe SP3, Jadi ikatan molekuler memiliki rotasi bebas.
Ada juga fenomena intrinsik etano, yang didasarkan pada rotasi struktur molekulnya dan energi minimum yang diperlukan untuk menghasilkan rotasi tautan 360 -derajat, yang oleh para ilmuwan disebut "etano barrera".
Untuk alasan ini, Ethan.
 Struktur kimia etana. Sumber: Wikimedia Commons
Struktur kimia etana. Sumber: Wikimedia Commons Sintesis etana
Estano dapat dengan mudah disintesis dari elektrolisis Kolbe, reaksi organik di mana dua langkah terjadi: dekarboksilasi elektrokimia (penghapusan gugus karboksil dan pembebasan karbon dioksida) dari dua asam karboksilat, dan kombinasi produk perantara untuk membentuk ikatan kovalen,.
Demikian pula, elektrolisis asam asetat menghasilkan pembentukan etana dan karbon dioksida, dan reaksi ini digunakan untuk mensintesis yang pertama.
Oksidasi anhidrida asetat dengan aksi peroksida, konsep yang mirip dengan elektrolisis Kolbe, juga menghasilkan pembentukan etana.
Dapat melayani Anda: Kontribusi dari Kimia ke KemanusiaanDengan cara yang sama, dapat dipisahkan secara efisien dari gas alam dan metana dengan proses pencairan, menggunakan sistem kriogenik untuk menangkap gas ini dan memisahkannya dari campuran dengan gas lain.
Proses ekspansi turbo adalah favorit untuk peran ini: campuran gas dibuat oleh turbin, menghasilkan ekspansi, sampai suhunya turun di bawah -100 ° C.
Sudah pada titik ini, komponen campuran dapat dibedakan, sehingga etana cair dari metana gas dan spesies lain yang terlibat dengan penggunaan distilasi akan dipisahkan.
Properti Estano
Estano disajikan di alam sebagai toilet dan gas tidak berwarna untuk tekanan dan suhu standar (1 atm dan 25 ° C). Ini memiliki titik didih -88,5 ° C, dan titik fusi -182,8 ° C. Selain itu, itu tidak terpengaruh oleh paparan asam atau basa yang kuat.
Kelarutan etana
Molekul etano adalah konfigurasi simetris dan memiliki gaya tarik yang lemah yang menjaga mereka tetap bersama, yang disebut kekuatan dispersi.
Ketika etana mencoba larut dalam air, kekuatan tarik yang terbentuk antara gas dan cairan sangat lemah, sehingga etana hampir tidak akan bergabung dengan molekul air.
Untuk alasan ini, kelarutan etana sangat rendah, sedikit meningkat ketika tekanan sistem naik.
Kristalisasi etana
Estano dapat dipadatkan, membuat kristal etana yang tidak stabil dengan struktur kristal kubik.
Dengan penurunan suhu di luar -183.2 ° C, struktur ini menjadi monoklinik, meningkatkan stabilitas molekulnya.
Pembakaran Ethane
Hidrokarbon ini, bahkan ketika tidak banyak digunakan sebagai bahan bakar, dapat digunakan dalam proses pembakaran untuk menghasilkan karbon dioksida, air dan panas, yang diwakili sebagai berikut:
2 c2H6 + 72 → 4co2 + 6h2O + 3120 kJ
Ada juga kemungkinan membakar molekul ini tanpa oksigen berlebih, yang dikenal sebagai "pembakaran tidak lengkap", dan yang menghasilkan pembentukan karbon amorf dan karbon monoksida dalam reaksi yang tidak diinginkan, sesuai dengan jumlah oksigen yang diterapkan:
Dapat melayani Anda: sterol: struktur, fungsi dan contoh2 c2H6 + 32 → 4c + 6h2Atau + panas
2 c2H6 + 42 → 2c + 2co + 6h2Atau + panas
2 c2H6 + Ke -52 → 4co + 6h2Atau + panas
Di daerah ini, pembakaran terjadi dengan serangkaian reaksi radikal bebas, yang diberi nomor dalam ratusan reaksi yang berbeda. Misalnya, dalam reaksi pembakaran yang tidak lengkap senyawa seperti formaldehida, asetaldehida, metana, metanol dan etanol dapat dibentuk.
Ini akan tergantung pada kondisi di mana reaksi dan reaksi radikal bebas yang terlibat terjadi. Ethylene juga dapat terbentuk pada suhu tinggi (600-900 ° C), yang merupakan produk yang sangat diinginkan oleh industri.
Estano di atmosfer dan di badan selestial
Estano hadir di atmosfer planet Bumi dalam jejak, dan diduga bahwa manusia telah berhasil menggandakan konsentrasi ini sejak ia mulai mempraktikkan kegiatan industri.
Para ilmuwan berpikir bahwa sebagian besar keberadaan ETA saat ini di atmosfer adalah karena pembakaran bahan bakar fosil, meskipun emisi etana dunia telah menurun hampir setengah sejak teknologi produksi gas Lutita ditingkatkan (sumber gas alam).
Spesies ini juga terjadi secara alami dengan efek sinar matahari pada metana atmosfer, yang menyusun kembali dan membentuk molekul etana.
Ada etana dalam keadaan cair di permukaan Titan, salah satu bulan Saturnus. Ini disajikan dalam jumlah yang lebih besar di Sungai Vid Flumina, yang mengalir lebih dari 400 kilometer ke salah satu lautnya. Senyawa ini juga telah dibuktikan pada komet, dan di permukaan pluto.
Penggunaan etana
Produksi etilen
Penggunaan Ethane didasarkan terutama pada produksi etilena, produk organik dengan penggunaan yang lebih besar dalam produksi dunia, melalui proses yang dikenal sebagai tahap uap.
Proses ini terdiri dari melewati Ethan yang encer.
Reaksi terjadi pada suhu yang sangat tinggi (antara 850 dan 900 ° C), tetapi waktu tinggal (waktu yang ditimbulkan oleh etana dalam oven) harus singkat sehingga reaksinya efektif. Pada suhu yang lebih tinggi, lebih banyak etilen dihasilkan.
Dapat melayani Anda: neon: sejarah, sifat, struktur, risiko, penggunaanPembentukan bahan kimia dasar
Etano juga telah dipelajari sebagai komponen utama dalam pembentukan bahan kimia dasar. Klorinasi oksidatif adalah salah satu proses yang diangkat untuk mendapatkan vinil klorida (komponen PVC), menggantikan orang lain yang kurang ekonomis dan lebih rumit.
Pendingin
Akhirnya, etana digunakan sebagai refrigeran dalam sistem kriogenik yang umum, juga menunjukkan kapasitas pembekuan sampel kecil di laboratorium untuk analisis.
Ini adalah pengganti air yang sangat baik, yang membutuhkan lebih banyak untuk mendinginkan sampel halus, dan juga dapat menghasilkan pembentukan kristal es berbahaya.
Risiko etana
-Estano memiliki kemampuan untuk meradang, terutama saat bergabung dengan udara. Persentase volume etana 3,0 hingga 12,5% di udara, campuran ledakan dapat dibentuk.
-Itu dapat membatasi oksigen di udara di mana ia ditemukan, dan untuk alasan ini ia menghadirkan faktor risiko mati lemas bagi manusia dan hewan yang ada dan terpapar.
-Etana dalam bentuk cair beku dapat secara serius membakar kulit jika bersentuhan langsung dengannya, dan juga bertindak sebagai media cryogenic untuk objek apa pun yang menyentuh, membekukannya di saat -saat.
-Uap etana cair lebih berat dari udara dan berkonsentrasi di tanah, ini dapat menghadirkan risiko pengapian yang dapat menghasilkan reaksi pembakaran rantai.
-Konsumsi etano dapat menyebabkan mual, muntah dan perdarahan internal. Menghirup, selain mati lemas, menyebabkan sakit kepala, kebingungan dan perubahan humor. Kematian akibat henti jantung dimungkinkan pada pameran tinggi.
-Ini mewakili gas rumah kaca yang, bersama dengan metana dan karbon dioksida, berkontribusi terhadap pemanasan global dan perubahan iklim yang dihasilkan oleh polusi manusia. Untungnya, kurang berlimpah dan bertahan dari metana, dan menyerap radiasi lebih sedikit dari ini.
Referensi
- Britannica, e. (S.F.). Ethane. Diperoleh dari Britannica.com
- Nes, g. V. (S.F.). Struktur kristal tunggal dan distribusi kerapatan elektron dari etana, ethylene dan asetilena. Karpet pulih.Nl
- Situs, g. (S.F.). Ethane: Sumber dan Wastafel. Diperoleh dari situs.Google.com
- Softschools (s.F.). Formula etana. Pulih dari sekolah lunak.com
- Wikipedia (s.F.). Ethane. Diperoleh dari dalam.Wikipedia.org

