Faktor yang mempengaruhi kelarutan
- 3225
- 382
- Jessie Harvey
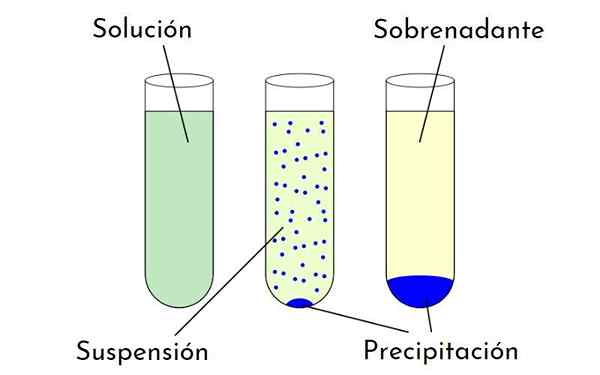
 Diagram yang menunjukkan perbedaan antara larutan, suspensi dan presipitasi yang membentuk endapan dan supernatan. Sumber: Zabmilenko: Orninalzofari: Vectormrmw: Dioptimalkan, Multilang, Wikimedia Commons
Diagram yang menunjukkan perbedaan antara larutan, suspensi dan presipitasi yang membentuk endapan dan supernatan. Sumber: Zabmilenko: Orninalzofari: Vectormrmw: Dioptimalkan, Multilang, Wikimedia Commons Apa faktor yang mempengaruhi kelarutan?
Utama faktor yang mempengaruhi kelarutan Mereka adalah polaritas, efek dari ion umum, suhu, tekanan, sifat zat terlarut dan faktor mekanik. Kelarutan adalah kemampuan bahan kimia padat, cair atau gas (disebut zat terlarut) untuk larut dalam pelarut (biasanya cairan) dan membentuk larutan.
Kelarutan suatu zat tergantung pada dasarnya pada pelarut yang digunakan, serta suhu dan tekanan. Kelarutan suatu zat dalam pelarut tertentu diukur dengan konsentrasi larutan jenuh.
Larutan dianggap jenuh ketika penambahan zat terlarut tambahan tidak lagi meningkatkan konsentrasi larutan.
Tingkat kelarutan sangat bervariasi tergantung pada zat, dari larut tanpa batas (sepenuhnya larut), seperti etanol dalam air, hingga sedikit larut, seperti perak klorida dalam air. Istilah "tidak larut" sering berlaku untuk senyawa yang sedikit larut.
Zat tertentu larut dalam semua proporsi dengan pelarut yang diberikan, seperti etanol dalam air. Properti ini dikenal sebagai Kesalahan.
Di bawah berbagai kondisi, kelarutan keseimbangan dapat diatasi untuk memberikan solusi yang disebut supers jenuh.
Faktor utama yang mempengaruhi kelarutan
1. Polaritas
Dalam kebanyakan kasus, zat terlarut larut dalam pelarut yang memiliki polaritas yang sama. Ahli kimia menggunakan pepatah populer untuk menggambarkan karakteristik zat terlarut dan pelarut ini: "serupa serupa".
Zat terlarut non -polar tidak larut dalam pelarut kutub dan sebaliknya.
2. Efek ion umum
Efek ion umum adalah istilah yang menggambarkan penurunan kelarutan senyawa ionik ketika garam mengandung ion yang sudah ada dalam keseimbangan kimia ditambahkan ke dalam campuran.
Efek ini paling baik dijelaskan oleh prinsip Le Châtelier. Bayangkan jika senyawa kalsium sulfat sedikit larut, case4, Itu ditambahkan ke air. Persamaan ionik bersih untuk keseimbangan kimia yang dihasilkan adalah sebagai berikut:
Case4 (s) ⇌ca2+(aq)+so42− (aq)
Kalsium sulfat sedikit larut. Dalam kesetimbangan, sebagian besar kalsium dan sulfat ada kokal dari kalsium sulfat.
Itu dapat melayani Anda: asam iarhydric (hai): struktur, sifat dan penggunaanMisalkan senyawa ionik larut tembaga sulfat (cuo4) Itu ditambahkan ke solusi. Tembaga sulfat larut. Oleh karena itu, satu -satunya efek penting pada persamaan ionik bersih adalah penambahan lebih banyak ion sulfat (jadi42-).
CUSO4 (S) ⇌CU2+(AQ)+SO42− (aq)
Ion sulfat yang terdisosiasi dari tembaga sulfat sudah ada (umum A) dalam campuran dari sedikit disosiasi kalsium sulfat.
Oleh karena itu, penambahan ion sulfat ini menekankan keseimbangan yang telah ditetapkan sebelumnya.
Prinsip Le Catelier menentukan bahwa upaya tambahan di sisi produk keseimbangan ini menghasilkan perubahan keseimbangan ke sisi reaktan untuk meringankan ketegangan baru ini.
Karena perubahan ke sisi yang bereaksi, kelarutan kalsium sulfat yang larut semakin berkurang.
3. Suhu
Suhu memiliki efek langsung pada kelarutan. Untuk sebagian besar padatan ionik, peningkatan suhu meningkatkan kecepatan solusinya dapat dibuat.
Dengan meningkatnya suhu, partikel padat bergerak lebih cepat, yang meningkatkan kemungkinan berinteraksi dengan lebih banyak partikel pelarut. Ini menghasilkan peningkatan kecepatan di mana solusi terjadi.
Suhu juga dapat meningkatkan jumlah zat terlarut yang dapat dilarutkan dalam pelarut. Secara umum, seiring dengan meningkatnya suhu, lebih banyak partikel zat terlarut larut.
Misalnya, saat gula ditambahkan ke air, itu adalah metode yang mudah untuk membuat solusi. Ketika larutan itu dipanaskan dan gula masih ditambahkan, ditemukan bahwa sejumlah besar gula dapat ditambahkan karena suhu terus meningkat.
Alasan hal ini terjadi adalah bahwa seiring dengan meningkatnya suhu, gaya antarmolekul dapat rusak lebih mudah, memungkinkan lebih banyak partikel zat terlarut tertarik pada partikel pelarut.
Dapat melayani Anda: magnesium: riwayat, struktur, sifat, reaksi, penggunaanNamun, ada contoh lain, di mana kenaikan suhu memiliki efek yang sangat kecil pada jumlah zat terlarut yang dapat dibubarkan.
Garam meja adalah contoh yang baik: Anda dapat melarutkan jumlah garam meja yang hampir sama dalam air es yang Anda bisa dalam air mendidih.
Untuk semua gas, seiring dengan meningkatnya suhu, kelarutan berkurang. Teori molekuler kinetik dapat digunakan untuk menjelaskan fenomena ini.
Ketika suhu meningkat, molekul gas bergerak lebih cepat dan mampu lepas dari cairan. Kelarutan gas, kemudian, berkurang.
4. Tekanan
Faktor keempat, tekanan, mempengaruhi kelarutan gas dalam cairan, tetapi tidak pernah dari padatan yang larut dalam cairan.
Saat tekanan diterapkan pada gas yang berada di atas permukaan pelarut, gas akan bergerak ke pelarut dan menempati beberapa ruang antara partikel pelarut.
Contoh yang baik adalah soda berkarbonasi. Tekanan diterapkan untuk memaksa molekul CO₂ dalam soda. Sebaliknya juga benar. Saat tekanan gas berkurang, kelarutan gas itu juga berkurang.
Saat minuman soda terbuka, tekanan dalam soda diturunkan, jadi gas segera mulai keluar dari larutan.
Karbon dioksida yang disimpan dalam soda dilepaskan, dan Anda dapat melihat effervescence pada permukaan cair. Jika kaleng soda yang terbuka dibiarkan untuk jangka waktu tertentu, kita dapat melihat bahwa minuman menjadi rata karena hilangnya karbon dioksida.
Faktor tekanan gas ini diungkapkan dalam hukum Henry. Hukum Henry menetapkan bahwa, pada suhu tertentu, kelarutan gas dalam cairan sebanding dengan tekanan parsial gas pada cairan.
Dapat melayani Anda: solusi normal: konsep, persiapan, contohContoh hukum Henry diproduksi dalam menyelam. Ketika seseorang membenamkan dirinya dalam air yang dalam, tekanan meningkat dan lebih banyak gas larut dalam darah.
Saat naik dari air yang dalam, penyelam perlu kembali ke permukaan dengan kecepatan yang sangat lambat untuk memungkinkan semua gas yang terlarut meninggalkan darah dengan sangat lambat.
Jika seseorang naik terlalu cepat, keadaan darurat medis dapat terjadi karena gas yang keluar dari darah terlalu cepat.
5. Sifat zat terlarut
Sifat zat terlarut dan pelarut dan adanya senyawa kimia lainnya dalam larutan mempengaruhi kelarutan.
Misalnya, Anda dapat melarutkan gula yang lebih besar dalam air, yang keluar dalam air. Dalam hal ini, dikatakan bahwa gula lebih larut.
Etanol dalam air benar -benar larut satu sama lain. Dalam kasus khusus ini, pelarut akan menjadi senyawa yang dalam jumlah yang lebih besar.
Ukuran zat terlarut juga merupakan faktor penting. Semakin besar molekul zat terlarut, semakin besar berat molekulnya dan ukurannya. Lebih sulit bagi molekul pelarut untuk mengelilingi molekul yang lebih besar.
Jika semua faktor yang disebutkan di atas dikecualikan, aturan umum dapat ditemukan bahwa partikel terbesar umumnya kurang larut.
Jika tekanan dan suhu sama dengan antara dua zat terlarut dari polaritas yang sama, yang dengan partikel yang lebih kecil biasanya lebih larut.
6. Faktor Mekanik
Berbeda dengan kecepatan larutan, yang terutama tergantung pada suhu, kecepatan rekristalisasi tergantung pada konsentrasi zat terlarut pada permukaan jaringan kristal, sebuah kasing yang disukai ketika larutan tidak bergerak.
Oleh karena itu, agitasi solusi menghindari akumulasi ini, memaksimalkan solusi.
Referensi
- Kelarutan. Pulih dari batas.com.
- Faktor -faktor yang membuat kelarutan. Pulih dari CK12.org.
- Mendidik online.F.). Faktor -faktor yang membuat kelarutan. Diperoleh dari kelarutan.com.

