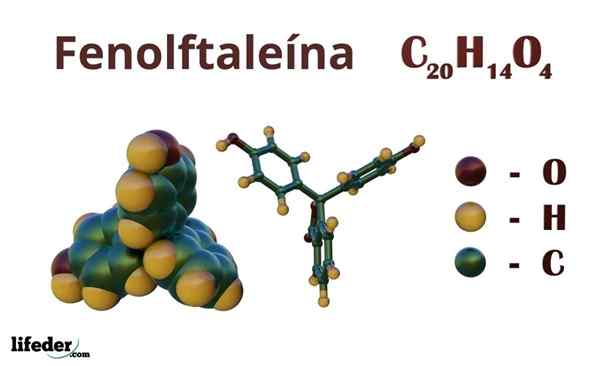
Phenolphthalein (C20H14O4)
- 1586
- 140
- Joseph Nader PhD
Apa itu fenolftalein?
Itu Phenolphthalein Ini adalah pewarna organik, yang pada gilirannya merupakan asam diprotik yang lemah, digunakan dalam banyak penentuan volumetrik sebagai indikator asam-basa. Yaitu, jika itu adalah asam diprotik, dalam larutan Anda dapat kehilangan dua ion H+, Dan menjadi indikator Anda harus memiliki properti berwarna -warni dalam kisaran pH yang dihargai.
Dalam medium dasar (pH> 8) fenolftalein berwarna merah muda, yang dapat diintensifkan ke ungu merah. Untuk digunakan sebagai indikator asam-basa, Anda tidak boleh bereaksi lebih cepat dengan OH- lingkungan yang menganalisis untuk menentukan.
Selain itu, karena itu adalah asam yang sangat lemah, keberadaan kelompok -COOH dikesampingkan dan, oleh karena itu, sumber proton asam adalah dua gugus OH yang terkait dengan dua cincin aromatik.
Rumus
Phenolphthalein adalah senyawa organik yang formula kimianya yang kental adalah Cdua puluhH14SALAH SATU4. Meskipun mungkin tidak cukup untuk menemukan kelompok organik mana yang dimiliki, dari formula Anda dapat menghitung ketidakjenuhan, untuk mulai menjelaskan kerangka Anda.
Struktur kimia
 Struktur fenolftalein
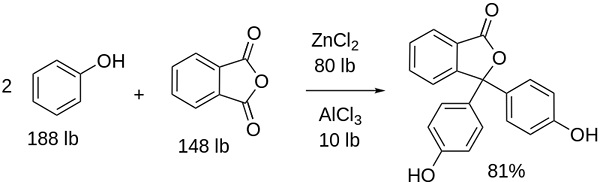
Struktur fenolftalein Struktur fenolftalein adalah dinamis, yang berarti mengalami perubahan tergantung pada pH lingkungannya. Dalam gambar superior struktur fenolftalein dalam kisaran 0 diilustrasikan Itu adalah cincin pentagonal yang menderita modifikasi terbesar. Misalnya, dalam media dasar, ketika salah satu kelompok OH cincin fenolik, beban negatif mereka (-O-) tertarik pada cincin aromatik, "membuka" cincin pentagonal dalam pengaturan baru tautannya. Di sini, beban negatif baru terletak di grup -coo-, yang "keluar" dari cincin pentagonal. Kemudian, setelah meningkatkan kebusukan medium, kelompok OH kedua dari cincin fenolik dan beban yang dihasilkan menghancurkan di seluruh struktur molekul adalah melahap. Gambar inferior merangkum hasil dari dua non -reprotonasi dalam media dasar. Struktur ini bertanggung jawab atas pewarnaan pink fenolftalein yang akrab. Elektron yang "bepergian" melalui sistem π terkonjugasi (diwakili dengan ikatan resonansi ganda) menyerap dalam spektrum yang terlihat, khususnya dengan panjang gelombang warna kuning, yang mencerminkan warna merah muda yang mencapai mata hamil dari hamil yang hamil. Phenolphthalein memiliki total empat struktur. Dua sebelumnya adalah yang paling penting dalam istilah praktis dan direpresentasikan disingkat sebagai: h2Di dalam dan dalam2-. Fenolftalein digunakan dalam analisis kimia sebagai indikator visual dalam menentukan titik kesetaraan dalam reaksi netralisasi atau derajat asam-basa. Reagen untuk penilaian asam-basa ini disiapkan pada 1 % dilarutkan dalam 90 % alkohol. Phenolphthalein menyajikan 4 negara bagian: Perilaku ini telah memungkinkan penggunaan fenolftalein sebagai indikasi karbonasi beton, yang memvariasikan pH ke nilai antara 8,5 hingga 9. Juga, perubahan warna sangat tiba -tiba; yaitu anion di2- Merah muda diproduksi dengan kecepatan tinggi. Akibatnya, ini memungkinkan Anda untuk menjadi kandidat sebagai indikator dalam banyak penentuan volumetrik; Misalnya, asam lemah (asam asetat) atau kuat (asam klorida). Phenolphthalein digunakan sebagai agen pencahar. Namun, ada literatur ilmiah indikatif bahwa beberapa pencahar yang mengandung fenolftalein sebagai prinsip aktif - yang bertindak menghambat penyerapan air dan elektrolit di usus besar yang mempromosikan evakuasi - dapat memiliki efek negatif. Penggunaan obat -obatan yang berkepanjangan ini yang mengandung fenolftalein dikaitkan dengan produksi beberapa gangguan dalam fungsi usus, pankreatitis dan bahkan kanker, yang diproduksi terutama pada wanita dan pada model hewan yang digunakan untuk studi farmakologis senyawa kimia ini. Fenolftalein yang dimodifikasi secara kimia, dan kemudian mengubahnya menjadi keadaan tereduksi, digunakan sebagai reagen dalam tes forensik yang memungkinkan menentukan keberadaan hemoglobin dalam sampel (uji Kastle-Meyer), yang tidak konklusif karena adanya positif palsu palsu). Ini dibentuk oleh kondensasi anhidrida phthalic dengan fenol, dengan adanya asam sulfat pekat, dan campuran aluminium dan seng klorida sebagai katalis dari reaksi: Substitusi elektrofilik aromatik adalah mekanisme yang mengatur reaksi ini. Terdiri dari apa? Cincin fenolik (molekul kiri) dimuat secara negatif berkat atom oksigen yang kaya elektron, yang mampu membuat pasangan bebas dari mereka melakukan perjalanan "sirkuit elektronik" dari cincin itu. Di sisi lain, karbon kelompok C = o dari anhidrida ftalic. Cincin fenolik, kaya elektron, menyerang karbon yang buruk ini dalam elektron, menggabungkan cincin pertama ke dalam struktur. Serangan ini terjadi secara istimewa di ujung karbon yang berlawanan dengan kelompok OH; Ini adalah posisinya -untuk. Hal yang sama berlaku untuk cincin kedua: ia menyerang karbon yang sama dan dari ini molekul air yang dihasilkan dilepaskan berkat media asam. Dengan cara ini, fenolftalein tidak lebih dari molekul anhidrida ftHalic yang telah memasukkan dua cincin fenolik ke dalam salah satu kelompok karbonilus (C = O). Penampilan fisiknya adalah dari padatan putih dengan kristal triklinik, sering diaglomerasi atau dalam bentuk jarum belah ketupat. Ini toilet, lebih padat dari air cair (1.277 g/ml pada 32 ºC), dan sangat sedikit volatil (perkiraan tekanan uap: 6,7 x 10-13 MMHG). Ini sangat sedikit larut dalam air (400 mg/L), tetapi sangat larut dalam alkohol dan eter. Untuk alasan ini, disarankan untuk mencairkannya dalam etanol sebelum digunakan. Ini tidak larut dalam pelarut aromatik seperti benzena dan toluena, atau dalam hidrokarbon alifatik seperti n-heksana. Ditemukan pada 262,5 ºC dan cairan memiliki titik didih 557,8 ± 50,0 ºC ke tekanan atmosfer. Nilai -nilai ini merupakan indikasi interaksi antarmolekul yang kuat. Ini karena jembatan hidrogen, serta interaksi depan antara cincin. PKA -nya adalah 9,7 hingga 25 ºC. Ini diterjemahkan menjadi tren yang sangat rendah untuk dipisahkan dalam media berair: H2Di (ac) + 2h2Atau (l) di2-(Ac) + 2h3SALAH SATU+ Ini adalah keseimbangan berair. Namun, peningkatan ion OH- Dalam solusi jumlah H saat ini berkurang3SALAH SATU+. Akibatnya, keseimbangan bergerak ke kanan, untuk menghasilkan lebih banyak h3SALAH SATU+. Dengan cara ini kehilangan awalnya dihargai. Karena lebih banyak basis ditambahkan, keseimbangan terus bergerak ke kanan, dan seterusnya sampai tidak ada spesies h2Di dalam. Pada titik ini, spesies di2- Rosado Warna solusinya. Akhirnya, fenolftalein terurai saat memanaskan, memancarkan hektar dan asap yang menjengkelkan.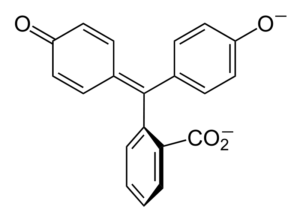
Penggunaan/Aplikasi Phenolphthalein
 Menambahkan larutan alkali ke larutan netral dengan indikator fenolftalein
Menambahkan larutan alkali ke larutan netral dengan indikator fenolftalein Fungsi indikator
Penggunaan dalam Kedokteran
Sintesis fenolftalein
Sifat fenolftalein
Referensi