Struktur magnesium fluoride, sifat, sintesis, penggunaan
- 728
- 188
- Miss Marion Graham
Dia Magnesium fluoride Ini adalah garam anorganik yang tidak berwarna yang formula kimianya mgf₂. Itu ditemukan di alam sebagai mineral sealíta. Ini memiliki titik fusi yang sangat tinggi dan sangat sedikit larut dalam air. Ini relatif lembam, karena, misalnya, reaksinya terhadap asam sulfat lambat dan tidak lengkap dan menahan hidrolisis dengan asam fluorhoric (HF) hingga 750ºC.
Itu adalah senyawa yang sedikit dipengaruhi oleh radiasi energi tinggi. Selain itu, ia memiliki indeks refraksi rendah, ketahanan korosi yang tinggi, stabilitas termal yang baik, kekerasan yang signifikan dan sifat transmisi cahaya tampak yang sangat baik, UV (ultraviolet) dan IR (inframerah).

Properti ini memiliki kinerja yang sangat baik di bidang optik dan, di samping itu, mereka menjadikannya bahan yang berguna seperti dukungan katalis, elemen pelapis, lensa anti -refleks dan jendela untuk transmisi inframerah, di antara aplikasi lainnya.
[TOC]
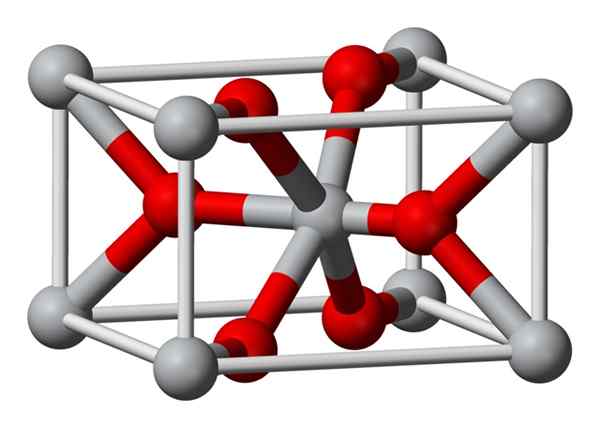
Struktur
Struktur kristal magnesium fluorida yang disiapkan secara kimia adalah jenis yang sama dengan mineral alami sellaíta. Mengkristal dalam kelas dipiramidal dari sistem tetragonal.
Ion magnesium (Mg2+) terletak di ruang berpusat pada ruang yang berpusat pada tetragonal, sedangkan ion fluoride (F-) ditemukan di bidang yang sama dari tetangga mereka Mg2+ dan terkait dengan ini, dikelompokkan berpasangan dengan masing-masing. Jarak antara ion Mg2+ dan F- adalah 2,07 Å (angstroms) (2,07 × 10-10m).
Koordinasi kristalnya adalah 6: 3. Ini berarti bahwa setiap ion Mg2+ dikelilingi oleh 6 ion F- dan masing-masing ion F-, pada gilirannya, dikelilingi oleh 3 mg2+ 5 ion.
Strukturnya sangat mirip dengan mineral rutilo, yang merupakan bentuk alami titanium dioksida (TiO2), yang memiliki beberapa sifat kristografi yang sama.
Selama memperolehnya, magnesium fluoride tidak mengendap dalam bentuk padatan amorf, karena Mg2+ dan F-ion tidak cenderung membentuk kompleks polimer dalam larutan.
Properti
Sangat menarik untuk menekankan bahwa magnesium fluoride adalah bahan birrefringent. Ini adalah properti optik yang memungkinkan Anda untuk membuka sinar cahaya insiden menjadi dua sinar terpisah yang menyebar pada gelombang dan panjang gelombang yang berbeda.
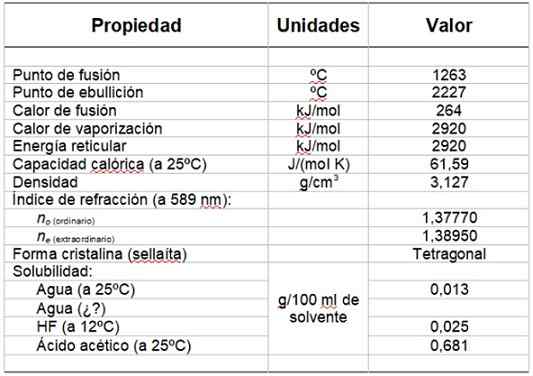
Dapat melayani Anda: grup hidroksilTabel 1 menunjukkan beberapa propertinya.
Tabel 1. Sifat fisik dan kimia magnesium fluoride.
Sintesis dan Persiapan
Ini dapat disiapkan dalam beberapa cara, di antaranya yang berikut ini dapat disebutkan:
1-karena reaksi antara magnesium oksida (MgO) atau magnesium karbonat (MGCO3) dengan asam fluorida (HF) 2:
Mgo + 2 hf mgf2 + h2o
MGCO3 + 2 HF MGF2 + CO2 + H2O
2-untuk reaksi antara magnesium karbonat dan amonium bifluoruro (NH4HF2), keduanya dalam keadaan padat, pada suhu antara 150 dan 400ºC2:
150-400ºC
MGCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-Calento Larutan berair magnesium karbonat dan amonium fluorida (NH4F) dengan adanya amonium hidroksida (NH4OH) pada 60ºC 2:
60ºC, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Endapan amonium dan magnesium fluorida (NH4MGF3) kemudian dipanaskan hingga 620ºC selama 4 jam untuk mendapatkan magnesium fluorida:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-sebagai produk sampingan dari memperoleh berilium (BE) dan uranium (U). Fluoride dari elemen yang diinginkan dengan magnesium logam dipanaskan dalam mgf2 2 -fovered melting pot:
Bef2 + mg be + mgf2
5-Hacing React magnesium chloride (MGCL2) dengan amonium fluoride (NH4F) dalam larutan berair pada suhu kamar 3:
25ºC, H2O
Mgcl2 + 2 nh4f mgf2 + 2nh4cl
Karena metode persiapan MGF2 mahal, ada upaya untuk mendapatkannya secara lebih ekonomis, di antaranya metode memproduksinya dari air laut.
Dapat melayani Anda: kalsium hidrida (CAH2): sifat, reaktivitas dan penggunaanIni ditandai dengan menambahkan ion fluoride yang cukup (F-) ke air laut, yang memiliki konsentrasi ion magnesium yang berlimpah (Mg2+), sehingga mendukung presipitasi Mgf2.
Kristal magnesium fluorida optik diperoleh dengan tekanan panas dari mgf2 berkualitas tinggi, diperoleh, misalnya, dengan metode NH4HF2.
Ada banyak teknik untuk menyiapkan bahan magnesium fluoride, seperti pertumbuhan kaca tunggal, sintering (pemadatan untuk jamur atau bentuk) tanpa tekanan, panas dan sintering ditekan dengan microwave.
Aplikasi
Optik
Kristal MGF2 cocok untuk aplikasi optik karena mereka transparan dari wilayah UV ke wilayah IR rata -rata 2,10.
Sebagai film inert digunakan untuk mengubah sifat transmisi cahaya bahan optik dan elektronik. Salah satu aplikasi utama adalah di VUV Optics for Space Exploration Technology.
Karena sifat birrefringencynya, bahan ini berguna dalam optik polarisasi, di jendela laser ecimer dan prisma (jenis laser ultraviolet yang digunakan dalam bedah mata).
Perlu dicatat bahwa magnesium fluorida yang digunakan dalam pembuatan bahan optik film tipis harus bebas dari kotoran atau senyawa yang merupakan sumber oksida, seperti air (H2O), ion hidroksida (OH-), ion karbonat (CO3 = ), Ion sulfat (SO4 =), dan serupa 12.
Katalisis atau percepatan reaksi
MGF2 telah berhasil digunakan sebagai dukungan katalis untuk reaksi eliminasi klorin dan penambahan hidrogen dalam CFC (klorofluorokarbon), pendingin dan penanaman aerosol yang terkenal, dan bertanggung jawab atas kerusakan atmosfer ozon.
Senyawa yang dihasilkan, HFC (hydrofluorocarbones) dan HCFC (hydrochlorofluorocarbones), tidak menyajikan efek berbahaya ini ke atmosfer 5.
Ini juga berguna sebagai dukungan untuk katalis untuk hidrodesulfrasi (eliminasi sulfur) dari senyawa organik.
Dapat melayani Anda: keseimbangan kimia: penjelasan, faktor, jenis, contohPenggunaan lainnya
Bahan yang dihasilkan oleh grafit, fluor dan mgf2 interleave.
Eutctic yang dibentuk oleh NAF dan MGF2 menyajikan sifat penyimpanan energi dalam panas laten, sehingga telah dipertimbangkan untuk digunakan dalam sistem energi surya.
Di area biokimia, magnesium fluorida, bersama dengan fluorida logam lainnya, digunakan untuk menghambat reaksi transfer fosforil dalam enzim.
Baru -baru ini, nanopartikel MGF2 telah berhasil diuji sebagai vektor penempatan obat dalam sel sakit untuk pengobatan kanker.
Referensi
- Buckley, h.DAN. dan vernon, w.S. (1925) xciv. Struktur kristal magnesium fluoride. Majalah Philosophical Seri 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, Volume 11, Edisi Kelima, John Wiley & Sons. ISBN 0-471-52680-0 (v.sebelas).
- Peng, Minhong; Cao, menghamburkan; dan lagu, Jinhong. (2015). Persiapan keramik transparan MGF2 dengan sintering yang menarik. Jurnal Wuhan University of Technology-Mater: SCI. Ed. Vol. 30 Tidak. 4.
- Непоконов, и.С. (2011). Magnesium fluoride. Sumber: pekerjaan sendiri.
- Wojciechowska, Maria; Zielinski, Michal; dan Piettowski, Mariusz. (2003). MGF2 sebagai dukungan katalis non-konfvensional. Jurnal Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluoride magnesium (MGF2). Berkonsultasi pada 07/12/2019 di: Korth.dari
- Sevonkaev, Igor dan Matijevic, Egon. (2009). Pembentukan partikel magnesium fluoride dari morfologi yang berbeda. Langmuu 2009, 25 (18), 10534-10539.
- Непоконов, и.С. (2013). Magnesium fluoride. Sumber: pekerjaan sendiri.
- Tao Qin, Peng Zhang dan Weiwei Qin. (2017). Metode baru untuk mensintesis bola magnesium fluorida berbiaya rendah dari air laut. Ceramics International 43 (2017) 14481-14483.
- Ensiklopedia Kimia Industri Ullmann (1996) Edisi Kelima. Volume A11. Vch verlagsgellschaft mbh. New York. ISBN 0-89573-161-4.
- NASA (2013). Insinyur Memeriksa Mirror Primer Teleskop Hubble Space 8109563. Sumber: Campurkan.Msfc.pot.Pemerintah
- « Asal penulisan piktografi, karakteristik dan contoh
- Karakteristik dan contoh transaksi komersial »

