Kalium fluoride (KF)
- 4928
- 721
- Herbert Fritsch
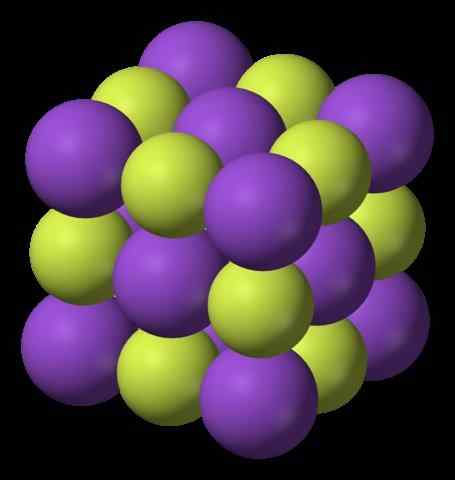
 Struktur Kalium Fluoride. Sumber: Benjah-BMM27, Wikimedia Commons
Struktur Kalium Fluoride. Sumber: Benjah-BMM27, Wikimedia Commons Apa itu kalium fluoride?Dia Kalium fluoride Ini adalah halogenida anorganik yang terdiri dari garam yang terbentuk antara logam dan halogen. Formula kimianya adalah KF, yang berarti bahwa untuk setiap kation k+ Ada f- dari mitra. Interaksi adalah elektrostatik, dan akibatnya tidak ada tautan kovalen K-F.
Garam ini ditandai dengan kelarutan ekstrem dalam air, sehingga membentuk hidrat, menyerap kelembaban dan lezat. Oleh karena itu, sangat mudah untuk menyiapkan solusi air, yang berfungsi sebagai sumber anion fluoride untuk semua sintesis di mana ia diinginkan untuk memasukkannya ke dalam beberapa struktur.
Ki diproduksi dengan bereaksi kalium karbonat dengan asam fluorhororat, menghasilkan kalium bifluoride (KHF2), yang, karena dekomposisi termal, akhirnya menyebabkan kalium fluoride.
Struktur Kalium Fluoride
Gambar atas menunjukkan struktur kalium fluoride. Bola ungu mewakili kation k+, Sedangkan bidang kekuningan mewakili anion f-.
Perhatikan bahwa pengaturannya adalah kubik dan sesuai dengan struktur garam GEMA, sangat mirip dengan natrium klorida. Semua bidang dikelilingi oleh enam tetangga, yang membentuk Octahedron KF6 atau fk6, Artinya, masing -masing k+ Itu dikelilingi oleh enam f-, Dan hal yang sama berlaku untuk sebaliknya.
Sebelumnya disebutkan bahwa KF adalah higroskopis dan, oleh karena itu, menyerap kelembaban lingkungan. Dengan demikian, pengaturan yang ditunjukkan akan sesuai dengan bentuk anhidrat (tanpa air) dan bukan dengan hidratnya, yang menyerap begitu banyak air yang bahkan melarutkan dan "meleleh" (hidangan lezat).
Dapat melayani Anda: neon: sejarah, sifat, struktur, risiko, penggunaanMelembabkan
Struktur kristal hidrat menjadi kurang sederhana. Karena sekarang molekul air mengintervensi langsung ke dalam pengaturan dan berinteraksi dengan ion K+ dan f-. Salah satu hidrat yang paling stabil adalah KF · 2H2O y kf · 4h2SALAH SATU.
Dalam kedua hidrat, octahedra yang baru disebutkan dideformasi karena molekul air. Ini terutama karena jembatan hidrogen antara f- dan h₂o (f--HOH). Studi kristalografi telah menentukan bahwa, meskipun demikian, kedua ion terus mempertahankan jumlah tetangga yang sama.
Akibatnya, struktur kubik asli untuk kalium fluorur anhidrat.
Anhydros berbagi delicuest.
Sifat kalium fluoride
- Berat molekul: 58.097 g/mol.
- Penampilan Fisik (Warna): Kristal kubik putih atau debu kristal lezat.
- Rasa: rasa garam akut.
- Titik didih: 2.741 ° F pada 760 mmHg (1502 ° C). Dalam keadaan cair itu menjadi konduktor listrik, meskipun anion mungkin- Jangan berkolaborasi dalam tingkat yang sama untuk mengemudi sebagai k+.
- Titik lebur: 1.576 ° F; 858 ° C; 1131 K (kf anhidro). Ini menunjukkan tautan ionik yang kuat.
- Kelarutan: Larut dalam HF, tetapi tidak larut dalam alkohol. Ini menunjukkan bahwa jembatan hidrogen antara fluoride dan alkohol, f--Hor, mereka tidak menyukai proses solvasi terhadap pembubaran jaringan kristalnya.
- Kelarutan air: Anhidrat 92 g/100 mL (18 ° C); 102 g/100 ml (25 ° C); Dihidrared 349,3 g/100 ml (18 ° C). Yaitu, karena KF terhidrasi, ia menjadi lebih larut dalam air.
- Kepadatan: 2.48 g/cm3.
- Tekanan uap: 100 kPa (750 mm Hg) di 1.499 ° C.
- Penguraian: Saat dia dipanaskan untuk dekomposisi, dia mengeluarkan asap beracun dari kalium oksida dan hidrogen fluorida.
- Tindakan korosif: Larutan berair merusak kaca dan porselen.
- Titik nyala: Ini bukan zat yang mudah terbakar
- Indeks refraksi eksperimental (ηd): 1.363.
- Stabilitas: stabil jika dilindungi dari kelembaban, karena jika tidak, padatan dibubarkan. Tidak sesuai dengan asam dan basa yang kuat.
Penggunaan Kalium Fluoride
- Sesuaikan ph: Larutan kalium fluoride berair digunakan dalam aplikasi dan proses industri. Misalnya, solusi KF memungkinkan pH disesuaikan dalam manufaktur yang dilakukan dalam pemrosesan tekstil dan fasilitas binatu (mereka mendekati nilai 7).
- Sumber fluor: Kalium fluorida, setelah hidrogen fluorida, sumber utama mendapatkan fluoride. Elemen ini digunakan dalam pembangkit nuklir dan dalam produksi senyawa anorganik dan organik, beberapa dengan kegunaan seperti penggabungannya dalam dentifriques.
- Sintesis Fluorocarbone: Kalium fluorida dapat digunakan dalam sintesis fluorbone atau fluorcarbide dari klorokarbon, dengan menggunakan reaksi Finkeistein. Dalam reaksi ini, etilen glikol dan dimetilsulfoksida digunakan sebagai pelarut.
- Fluorinasi: Seperti halnya sumber fluor di mana terletak dilarutkan dalam air, dari solusi mereka, mereka dapat mensintesis fluorida kompleks, yaitu, mereka dimasukkan dengan f- untuk struktur. Contohnya adalah dalam persamaan kimia berikut:
MNBR2(ac) + 3kf (ac) => kmnf3(S) + 2KBR (AC)
- Kemudian mengendapkan fluoride campuran KMNF3. Dengan demikian, f bisa ditambahkan- menjadi bagian dari garam logam yang kompleks. Selain mangan, fluorida logam lain dapat terburu -buru: kcof3, Kfef3, Knif3, Kcf3 dan kznf3.
- Demikian juga, fluoride dapat secara kovalen dimasukkan ke dalam cincin aromatik, mensintesis organisasi.
- Beberapa: KF digunakan sebagai bahan menengah atau mentah untuk sintesis senyawa yang terutama digunakan dalam produk agrokimia atau pestisida.
- Selain itu, digunakan sebagai agen pendiri las.
Referensi
- Kalium fluoride. Dipulihkan dari Chemicalbook.com.
- Kalium fluoride. Pulih dari pubchem.NCBI.Nlm.Nih.Pemerintah.

