Karakteristik FUCOSA, Struktur, Fungsi
- 3159
- 227
- Leland Robel
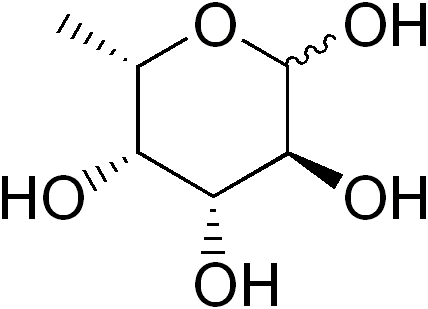
Itu Fucosa (Disiarkan FUC), atau 6-L-deksi-galaktosa, ini adalah monosakarida deoksigenado (deoxiazúcar) sebagian dari enam karbon yang formula empirisnya adalah C adalah C adalah C Is Is6H12SALAH SATU5. Seperti monosakarida lainnya, itu adalah gula polihidroksilasi.
Ketika gugus hidroksil digantikan oleh atom hidrogen, deoxiazúcar diturunkan. Meskipun secara teoritis penggantian ini dapat mempengaruhi kelompok hidroksil dari monosakarida apa pun, di alam ada sedikit variasi dexiazúcús.
 Sumber: Edgar181 [Domain Publik]
Sumber: Edgar181 [Domain Publik] Beberapa deoxiazúces adalah: 1) deoxyribosa (2-disoxxi-d-libose), berasal dari D-libose, yang merupakan bagian dari DNA; 2) Ramnosa (6-D-Dexi-Marso), berasal dari D-Manosa; 3) Fucosa, berasal dari L-galaktosa. Yang terakhir lebih sering dari D-fucosa, berasal dari D-galaktosa.
[TOC]
Karakteristik dan Struktur
Fucosa juga dikenal dengan 6-disoxxi-scalact-hexose, fucopiranous, galactomethyl dan rodeous nama.
Meskipun biasanya membentuk polisakarida dan glikoprotein, diisolasi sebagai monosakarida lebih manis dari galaktosa. Ini karena penggantian gugus hidroksil dengan atom hidrogen meningkatkan karakter hidrofobik dan, oleh karena itu, rasa manis molekul.
Kelompok hidroksil fucosa dapat mengalami reaksi yang sama dengan gula lainnya, menghasilkan berbagai macam asetal, glikosida, eter dan ester.
Biomolekul fucosilated adalah salah satu yang, dengan aksi fucosyltransferase, mereka telah bergabung, dengan ikatan glikosida, molekul fucosa. Ketika hidrolisis ikatan glikosida terjadi dengan aksi fucosidase, sehingga memisahkan fucosa, dikatakan bahwa biomolekul telah didefuksi.
Saat glucanos fucosyl, glucan yang lebih kompleks yang disebut fucanos dihasilkan, yang mungkin atau mungkin bukan bagian dari glikoprotein. Fucans sulfat didefinisikan sebagai polisakarida yang mengandung residu sulfat L-fucosa. Mereka khas dari ganggang coklat. Sebagai contoh mereka dapat ditunjuk sebagai Ascophilano, Sargasano dan Pelvetano.
Salah satu fucanos yang paling banyak dipelajari adalah fucoidano, diperoleh dari alga coklat Fucus vesiculosus, yang telah dipasarkan (Sigma-Aldrich Chemical Company) selama beberapa dekade.
Dapat melayani Anda: apa erristeneo?Distribusi di alam
D-fucose hadir dalam zat antibiotik yang diproduksi oleh mikroba, dan pada glikosida nabati, seperti kebetulan, charrtreusine, ledienosida dan queirotoxin.
L-fucose adalah konstituen dari polisakarida dari ganggang, lembaran plum, liner linen, kedelai dan canola, karet tragacanto, dinding sel kentang, umbi singkong, buah kiwi, Korteks Ceiba dan Mucigel Caliptra Jagung, serta tanaman lainnya.
L-fucosa juga hadir dalam telur landak laut dan jeli yang melindungi telur katak.
Pada mamalia, fucans dengan L-fucosa membentuk ligan yang bertindak dalam adhesi leukosit-endotelial yang dimediasi terpilih, dan berpartisipasi dalam berbagai peristiwa ontogenetik.
L-Fucosa berlimpah di fucoesphingolipids dari epitel gastrointestinal dan sumsum tulang, dan muncul dalam proporsi kecil pada tulang rawan dan struktur keratinous.
Pada manusia, fucanos dengan L-fucosa adalah bagian dari glikoprotein air liur dan jus lambung. Mereka juga merupakan bagian dari antigen yang mendefinisikan kelompok darah Abo. Mereka hadir dalam beberapa oligosakarida ASI.
Metabolisme Fucosa
Fucosyltransferases menggunakan fucose PDB, bentuk fucosa yang diaktifkan oleh nukleotida, sebagai donor fucosa dalam konstruksi oligosakarida fucosylated.
PDB-Fucosa berasal dari PDB-Manosa untuk tindakan berturut-turut dari dua enzim: GDP-Manasea 4.6-dehydratasa dan PDB-4-Zo-6-desoksimanosa 3.5-epimerasa-4-reduktase.
Uitlizing kofaktor NADP+, enzim pertama mengkatalisasi dehidrasi PDB-banyak. Pengurangan posisi 6 dan oksidasi posisi 4 menghasilkan PDB-6-desoksi-4-keto-koaming (selama reaksi, hibrida ditransfer dari posisi 4 hingga 6 gula).
Enzim kedua, yang bergantung pada NADPH, mengkatalisasi epimerisasi posisi 3 dan 5, dan jaringan kelompok 4-ZO, dari PDB-6-desoksi-4-ecto-mamosa.
Bakteri dapat tumbuh menggunakan fucosa sebagai sumber tunggal karbon dan energi melalui fucosa yang diinduksi opeone yang mengkode enzim katabolik untuk gula ini.
Dapat melayani Anda: asam karboksilatProses sebelumnya melibatkan: 1) entri FUCOSA gratis melalui dinding sel dengan mediasi permease; 2) isomerisasi fucosa (aldosa) untuk membentuk fuculous (zea); 3) fosforilasi fuculous untuk membentuk fuculous-1-fosfat; 4) Reaksi aldolase untuk membentuk lactaldehyde dan dihydroxyacetone fosfat dari fuculous-1-fosfat.
Fungsi
Kertas kanker
Di antara gejala banyak jenis tumor karsinogenik adalah adanya protein terhubung glukan yang dibedakan dengan memiliki komposisi oligosakarida yang diubah. Kehadiran glucan abnormal ini, di antaranya Fucanos menonjol, terkait dengan keganasan dan potensi metastasis tumor ini.
Pada kanker payudara, sel -sel tumor menggabungkan FUCOSA ke dalam glikoprotein dan glikolipid. Fucosa berkontribusi pada perkembangan kanker ini, mendukung aktivasi sel induk kanker, metastasis hematogenik dan invasi tumor melalui matriks ekstraseluler.
Pada karsinoma paru dan hepatokarsinogenesis, ekspresi augmented fucosa terkait dengan potensi metastasis yang tinggi dan dengan probabilitas kelangsungan hidup yang rendah.
Sebagai mitra, beberapa fucano tersulfasi adalah zat yang menjanjikan dalam pengobatan kanker, sebagaimana ditentukan.
Kertas dalam penyakit lain
Ekspresi augmented fucanos dalam imunoglobulin serum telah terkait dengan rheumatoid arthritis remaja dan dewasa.
Kekurangan adhesi leukosit II adalah penyakit bawaan yang langka karena mutasi yang mengubah aktivitas transporter fdp-fucose yang terletak di peralatan Golgi.
Pasien menderita penundaan mental dan psikomotorik, dan menderita infeksi bakteri berulang. Penyakit ini merespons dosis fucosa oral.
Potensi biomedis
Fucanos sulfat yang diperoleh dari ganggang coklat adalah reservoir penting senyawa dengan potensi terapeutik.
Itu dapat melayani Anda: ititrium: struktur, sifat, penggunaan, mendapatkanMereka memiliki sifat anti -inflamasi dan antioksidan, menghambat migrasi limfosit di lokasi infeksi dan mendukung pelepasan sitokin. Tingkatkan respons imun dengan mengaktifkan limfosit dan makrofag.
Mereka memiliki sifat antikoagulan. Telah terbukti pada pasien manusia yang secara oral menghambat agregasi trombosit.
Mereka memiliki potensi antibiotik dan antiparasit dan menghambat pertumbuhan bakteri patogen lambung Helicobacter pylori. Bunuh parasit Plasmodium spp. (Agen kausal malaria) dan Leishmania Donovani (Agen kausal visceotropic leishmaniasis Amerika).
Akhirnya, mereka memiliki sifat antivirus yang kuat, menghambat masuk ke sel beberapa virus yang sangat penting bagi kesehatan manusia, termasuk Arenavirus, Sitomegalovirus, Hantavirus, Hepadnavirus, HIV, virus herpes simplex, dan virus influenza.
Referensi
- Becker, d. J., Lowe, J. B. 2003. FUCOSE: Biosintesis dan fungsi biologis pada mamalia. Glycobiology, 13, 41R-53R.
- Deniaud-Bouët, e., Hardouin, k., Potin, hlm., Kloareg, b., Hervé, c. 2017. Tinjauan tentang dinding sel alga coklat dan polisakarida sulfasi yang mengandung fucose: konteks dinding sel, sifat biomedis dan tantangan penelitian utama.Polimer Karbohidrat, http: // dx.doi.org/10.1016/j.Karbol.2017.07.082.
- Bunga h. M. 1981. Kimia dan Biokimia D-dan L-Fucose. Kemajuan dalam Kimia dan Biokimia Karbohidrat, 39, 279-345.
- Listinsky, J. J., Siegal, g. P., Listinsky, c. M. 2011. Pentingnya yang muncul α-L-fucose pada kanker payudara manusia: ulasan. SAYA. J. Menerjemahkan. Daging sapi., 3, 292-322.
- Murray, r. K., et al. 2003. Biokimia Illustrated Harper. McGraw-Hill, New York.
- Pereira, l. 2018. Penggunaan alga terapeutik dan nutrisi. CRC Press, Boca Raton.
- Staudacher, e., Altmann, f., Wilson, i. B. H., März, l. 1999. Fucose di n-glikan: dari tanaman ke manusia. Biochimica et Biophysica Acta, 1473, 216-236.
- Tanner, w., Loewus, f. KE. 1981. Tanam karbohidrat II. Karbohidrat ekstraseluler. Springer, New York.
- Vanhooren, hlm. T., Vandamme, e. J. 1999. L-fucose: kejadian, peran fisiologis, kimia, sintesis enzimatik dan mikroba. Jurnal Teknologi dan Bioteknologi Kimia, 74, 479-497.
- « Lokasi Lingkaran Kutub Antartika, Karakteristik, Flora dan Fauna
- Fase kemosintesis, organisme, perbedaan dengan fotosintesis »

