Pasukan London
- 2302
- 127
- Miss Wm Hudson
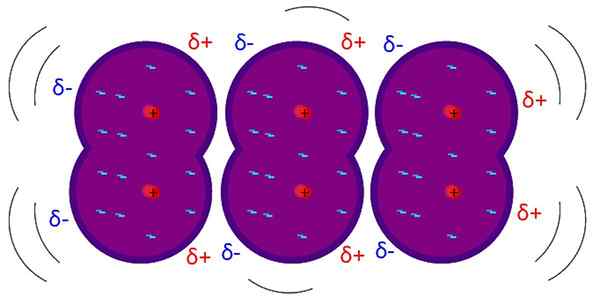
 Pasukan London adalah interaksi lemah antar molekul. Sumber: Riccardo Rovinetti, Wikimedia Commons
Pasukan London adalah interaksi lemah antar molekul. Sumber: Riccardo Rovinetti, Wikimedia Commons Apa Pasukan London?
Itu Pasukan London, Kekuatan dispersi London atau interaksi dipol yang diinduksi, adalah jenis interaksi antarmolekul terlemah. Namanya adalah karena kontribusi fisikawan teoretis Fritz London (1900-1954) dan studinya dalam bidang fisika kuantum.
Pasukan London menjelaskan bagaimana molekul berinteraksi yang struktur dan atomnya membuat pembentukan dipol permanen; yaitu, pada dasarnya berlaku untuk molekul atau atom apolar yang diisolasi dari gas mulia.
Berbeda dengan gaya Van der Waals lainnya, ini membutuhkan jarak yang sangat pendek.
Karakteristik Pasukan London
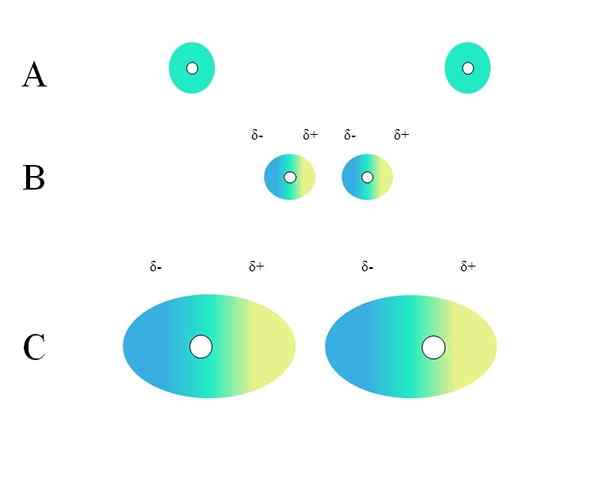 Distribusi tuduhan homogen. Sumber: Gabriel Bolívar
Distribusi tuduhan homogen. Sumber: Gabriel Bolívar Karakteristik apa yang harus dimiliki molekul sehingga dapat berinteraksi melalui pasukan London? Jawabannya adalah bahwa siapa pun dapat melakukannya, tetapi ketika ada momen dipol permanen, interaksi tipe dipol-dipolo mendominasi daripada dispersi, berkontribusi sangat sedikit pada sifat fisik zat tersebut.
Dalam struktur di mana tidak ada atom yang sangat elektronegatif atau distribusi beban elektrostatik yang homogen, tidak ada ujung atau wilayah yang dapat dianggap kaya (Δ-) atau buruk (Δ+) dalam elektron.
Dalam kasus ini, jenis kekuatan lain harus campur tangan, atau senyawa ini hanya dapat ada dalam fase gas, terlepas dari bahkan kondisi tekanan atau suhu yang beroperasi di atasnya.
Distribusi beban yang homogen
Dua atom yang terisolasi, seperti neon atau argon, memiliki distribusi beban yang homogen. Ini bisa dilihat pada gambar yang unggul. Lingkaran putih di tengah mewakili inti, untuk atom, atau kerangka molekul, untuk molekul. Distribusi beban ini dapat dianggap sebagai awan elektron hijau.
Mengapa gas mulia memenuhi homogenitas ini? Karena mereka memiliki lapisan elektronik mereka sepenuhnya penuh, sehingga elektron mereka secara teoritis harus merasakan secara setara dengan daya tarik beban nukleus di semua orbital.
Di sisi lain, untuk gas lain seperti oksigen atom (O), lapisannya tidak lengkap (yang diamati dalam konfigurasi elektroniknya) dan memaksanya membentuk molekul diatomik atau2 Untuk mengimbangi kekurangan ini.
Lingkaran hijau juga bisa berupa molekul, kecil atau besar. Awan elektron orbitnya di sekitar semua atom yang menebusnya, terutama tentang yang paling elektronegatif. Di sekitar atom -atom ini awan akan berkonsentrasi dan akan lebih negatif, sementara atom lain akan memiliki kekurangan elektronik.
Dapat melayani Anda: ikatan kovalen non -polarNamun, awan ini tidak statis tetapi dinamis, jadi pada beberapa titik singkat daerah Δ- dan Δ+akan dibentuk, dan fenomena yang disebut akan terjadi Polarisasi.
Kemampuan polarisasi
Di awan hijau menunjukkan distribusi beban negatif yang homogen. Namun, gaya tarik positif yang diberikan oleh nukleus dapat berkisar pada elektron. Ini menyebabkan deformasi awan dengan demikian menciptakan Δ- daerah, biru, dan Δ+, kuning.
Momen dipol yang tiba -tiba ini dalam atom atau molekul ini dapat mendistorsi awan elektronik yang berdekatan; Dengan kata lain, itu menginduksi dipol mendadak di atas tetangganya (B, citra superior).
Ini karena Δ- wilayah mengganggu awan tetangga, elektronnya merasakan tolakan elektrostatik dan berorientasi pada kutub yang berlawanan, muncul δ+.
Perhatikan bagaimana kutub positif selaras dengan negatif, seperti molekul dengan momen dipol permanen. Semakin banyak awan elektronik, semakin sulitnya nukleus akan membuatnya homogen di ruang angkasa; Dan di samping itu, itu akan menjadi deformasi, seperti yang dapat dilihat di C.
Oleh karena itu, atom dan molekul kecil lebih tidak mungkin terpolarisasi oleh partikel di sekitarnya. Contoh untuk situasi ini diilustrasikan oleh molekul hidrogen kecil, h2.
Untuk mengembun, atau bahkan lebih, mengkristal, membutuhkan tekanan selangit untuk memaksa molekulnya untuk berinteraksi secara fisik.
Berbanding terbalik dengan jarak
Meskipun dipol instan terbentuk yang mendorong orang lain di sekitar mereka, mereka tidak cukup untuk menyatukan atom atau molekul.
Di B ada jarak D Itu memisahkan dua awan dan dua inti mereka. Sehingga kedua dipol dapat tetap untuk sementara waktu dipertimbangkan, jarak ini D Itu pasti sangat kecil.
Kondisi ini harus dipenuhi, karakteristik penting dari pasukan London (ingat penutupan velcro), sehingga efek terkenal pada sifat fisik materi disediakan.
Sekali D menjadi kecil, inti kiri di B akan mulai menarik wilayah biru Δ- dari atom atau molekul tetangga. Ini selanjutnya akan merusak awan, seperti yang dapat dilihat pada C (nukleus tidak lagi di tengah tetapi di sebelah kanan).
Dapat melayani Anda: alkenaLalu, ada titik di mana kedua awan menyentuh dan "memantul", tetapi cukup lambat untuk memilikinya bersama dengan waktu.
Oleh karena itu, pasukan London berbanding terbalik dengan jarak D. Faktanya, faktornya sama dengan D7, Jadi variasi jarak minimal antara kedua atom atau molekul akan melemahkan atau memperkuat dispersi London.
Itu berbanding lurus dengan massa molekul
Cara meningkatkan ukuran awan sehingga lebih mudah terpolarisasi? Menambahkan elektron, dan untuk itu nukleus harus memiliki lebih banyak proton dan neutron, sehingga meningkatkan massa atom; atau menambahkan atom ke kerangka molekul, yang pada gilirannya akan meningkatkan massa molekulnya.
Dengan cara ini, inti atau kerangka molekuler akan lebih kecil kemungkinannya untuk menjaga awan elektronik sepanjang waktu mereka. Oleh karena itu, semakin besar lingkaran hijau yang dipertimbangkan dalam A, B dan C, semakin banyak yang bisa dipolarisasi dan lebih besar juga akan menjadi interaksi mereka oleh pasukan London.
Efek ini jelas diamati antara B dan C, dan bisa lebih dari itu jika lingkarannya berdiameter lebih besar. Alasan ini adalah kunci untuk menjelaskan sifat fisik dari banyak senyawa tergantung pada massa molekulnya.
Contoh Pasukan London
 Contoh Alami Pasukan London: Kaki Gecos
Contoh Alami Pasukan London: Kaki Gecos Di alam
Dalam kehidupan sehari -hari ada banyak contoh kekuatan dispersi London tanpa perlu usaha, dalam contoh pertama, dunia mikroskopis.
Salah satu contoh yang paling umum dan mengejutkan ditemukan di kaki reptil yang dikenal sebagai GECO (gambar superior) dan pada banyak serangga (juga di Spiderman).
Di kaki mereka mereka memiliki beberapa bantalan yang ribuan filamen kecil menonjol. Pada gambar Anda dapat melihat GECO berpose di lereng batu. Untuk mencapai hal ini, ia memanfaatkan kekuatan antar molekul antara batu dan filamen kaki mereka.
Masing -masing filamen ini berinteraksi dengan lemah dengan permukaan yang melaluinya reptil kecil. GECOS juga dapat memanjat permukaan yang halus dan sempurna seperti kristal.
Itu dapat melayani Anda: kalium nitrit (kno2): struktur, sifat dan penggunaanDitutup
Alkana adalah hidrokarbon jenuh yang juga berinteraksi oleh pasukan London. Struktur molekulnya hanya terdiri dari karbon dan hidrogen yang disatukan oleh ikatan sederhana. Karena perbedaan elektronegativitas antara C dan H sangat kecil, mereka adalah senyawa apolar.
Jadi, metana, cho4, Hidrokarbon terkecil dari semuanya, mendidih di -161.7 C. Karena C dan H ditambahkan ke kerangka, alkana lain diperoleh dengan massa molekul yang lebih tinggi.
Dengan cara ini, Ethane muncul (-88.6 C), butana (-0.5 C) dan oktan (125.7 C). Perhatikan bagaimana titik mendidih mereka meningkat saat alkana menjadi lebih berat.
Ini karena awan elektronik mereka lebih terpolarisasi dan strukturnya memiliki area superfisial yang lebih besar, yang meningkatkan kontak antara molekulnya.
Octane, meskipun merupakan senyawa apolar, memiliki titik didih lebih besar dari air.
Halogen dan gas
Pasukan London juga hadir di banyak zat gas. Misalnya, n molekul2, H2, BERSAMA2, F2, Cl2 Dan semua gas mulia berinteraksi melalui kekuatan -kekuatan ini, karena mereka memiliki distribusi elektrostatik yang homogen, yang mungkin mengalami snapshot dan menimbulkan polarisasi.
Gas mulia adalah dia (helium), neon (neon), ar (argon), kr (kripton), xe (xenon) dan rn (radon). Dari kiri ke kanan titik didih mereka meningkat dengan meningkatnya massa atom: -269, -246, -186, -152, -108, dan -62 ºC.
Halogen juga berinteraksi melalui kekuatan -kekuatan ini. Fluor adalah gas pada suhu kamar, seperti klorin. Bromin, dengan massa atom yang lebih besar, dalam kondisi normal seperti cairan kemerahan, dan yodium, untuk mengakhiri, membentuk padatan ungu yang dengan cepat menyublim karena lebih berat dari halogen lainnya.
Referensi
- Whitten, Davis, Peck & Stanley. Kimia. (Edisi ke -8.). Pembelajaran Cengage, hal 452-455.
- Angeles Méndez. (22 Mei 2012). Pasukan Dispersi (dari London). Dipulihkan dari: Kimia.LAGUIA2000.com
- Pasukan Dispersi London. Pulih dari: chem.Purdue.Edu
- Helmestine, Anne Marie, PH.D. (22 Juni 2018). 3 jenis kekuatan antarmolekul. Pulih dari: thinkco.com
- Ryan Ilagan & Gary L Bertrand. Interaksi dispersi London. Diambil dari: chem.Librettexts.org
- Norials Chempages. Pasukan London. Pulih dari: chem.Wisc.Edu
- Kamereon. (22 Mei 2013). Salamanqueas: GECO dan kekuatan Van der Waals. Pulih dari: almabiologica.com

