Pasukan Van der Waals
- 4069
- 304
- Tommie Smith
Kami menjelaskan apa yang menjadi kekuatan, karakteristik, jenisnya, dan memberikan contoh di masing -masing
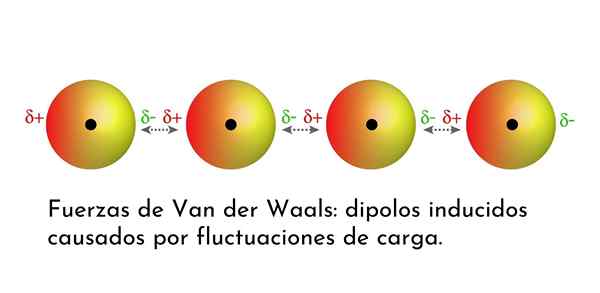
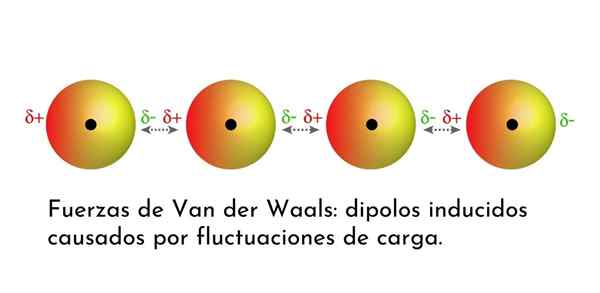 Ilustrasi yang menunjukkan salah satu jenis kekuatan van der Waals, pasukan dispersi London, di antara beberapa atom dengan dipol instan
Ilustrasi yang menunjukkan salah satu jenis kekuatan van der Waals, pasukan dispersi London, di antara beberapa atom dengan dipol instan Apa Pasukan Van Der Waals?
Itu Pasukan Van der Waals Mereka adalah satu set gaya tarik pendek antara semua atom dan molekul. Mereka menerima nama mereka untuk menghormati ilmuwan Belanda Johannes Diderik van der Waals.
Kekuatan -kekuatan ini relatif lemah, tetapi muncul di seluruh permukaan kontak antara dua atom, antara dua molekul atau antara dua permukaan, jadi, jika permukaan kontak tersebut besar, kekuatan van der Waals dapat menjadi cukup besar.
Pemahaman kekuatan van der Waals memungkinkan secara kualitatif memprediksi banyak sifat fisik zat kimia, seperti titik peleburan dan mendidih dan kelarutan dalam berbagai jenis pelarut. Ini adalah kekuatan yang memungkinkan untuk menjelaskan bagaimana mungkin bahwa gas monoatomik seperti helium, yang tidak membentuk jenis ikatan kimia apa pun, dapat memadatkan dan bergerak ke keadaan cair.
Kekuatan -kekuatan ini juga menjelaskan mengapa suatu zat seperti air, yang dibentuk oleh molekul yang massa molar yang hanya 18 g/mol, cair, sedangkan klorin, yang beratnya hampir 4 kali lebih banyak, adalah gas pada suhu kamar pada suhu kamar.
Karakteristik Pasukan Van der Waals
Selain mewakili jenis daya tarik antara atom dan molekul, kekuatan van der Waals tidak berbagi banyak karakteristik dengan ikatan kimia. Selanjutnya, karakteristik paling menonjol dari jenis kekuatan ini disajikan:
- Mereka adalah kekuatan yang bergantung pada jarak. Dalam kasus paling sederhana, mereka berkurang dengan kuadrat jarak. Selain itu, mereka sangat bergantung pada geometri molekuler.
- Dibandingkan dengan gaya tarik yang terjadi pada tautan ionik, kovalen dan logam, kekuatan van der Waals relatif lemah.
- Dengan pengecualian interaksi dipol-dipolo, mereka adalah interaksi suhu independen.
- Mereka adalah kekuatan pendek, yang berarti mereka menurun dengan cepat ketika atom dan molekul pindah.
- Mereka adalah kekuatan umum yang terjadi antara atom dan molekul apa pun.
- Tidak seperti ikatan kovalen, mereka tidak memiliki arah. Ini berarti bahwa, terlepas dari orientasi yang mendekati dua molekul, jika mereka cukup mendekat, pasukan van der Waals akan selalu muncul.
- Ketika dua molekul atau atom terlalu banyak mendekati, gaya menjadi menjijikkan, yang mencegah molekul saling runtuh.
- Mereka aditif, yang berarti bahwa, meskipun sangat lemah, keberadaan banyak interaksi simultan dapat menyebabkan kekuatan daya tarik total menjadi cukup besar.
Jenis Pasukan Van Der Waals
Selain komponen menjijikkan yang memastikan bahwa atom dan molekul tidak runtuh, ada tiga jenis gaya van der Waals, yang mungkin atau mungkin tidak bertindak pada saat yang sama antara dua molekul atau atom. Ini disajikan di bawah ini:
1. Interaksi dipolo-dipolo atau kekuatan keesom
Kekuatan Keesom adalah salah satu pembayar pajak untuk kekuatan van der Waals. Ini adalah gaya interaksi elektrostatik yang muncul di antara dipol permanen molekul kutub seperti air, aseton dan lainnya.
Kekuatan Keesom mirip dengan gaya elektrostatik antar ion, tetapi berbeda dari ini karena mereka jauh lebih lemah dan membusuk dengan kekuatan keenam jarak (yaitu, dengan r6). Alasan mengapa mereka lebih lemah adalah bahwa daya tarik terjadi antara beban parsial dipol, bukan muatan seluruh listrik seperti dalam kasus ion.
Interaksi ini hanya diberikan antara molekul dan bukan antara atom, karena atom tidak memiliki momen dipol permanen. Selain itu, kekuatan Keesom berbanding terbalik dengan suhu, yang berarti bahwa, ketika meningkat, kekuatan Keesom berkurang.
Contoh molekul yang memiliki interaksi dipol-dipolo
Semua molekul kutub memiliki interaksi dipol-dipol di antara mereka. Misalnya:
- Dua molekul aseton.
- Dua molekul kloroform.
- Molekul sikloheksanon dengan molekul aseton.
2. Interaksi dipolo-dipolo yang diinduksi atau kekuatan debye
Saat molekul kutub mendekati atom atau molekul apolar, dipol yang pertama menarik atau mengulangi elektron pada permukaan yang kedua. Ini menginduksi dipol dalam molekul apolar, yang disebut dipol yang diinduksi. Dipol baru terbentuk, kemudian berinteraksi dengan dipol asli yang menciptakan gaya tarik kecil.
Dapat melayani Anda: panas pembakaranInteraksi antara dipol permanen dan yang diinduksi ini biasanya dikenal sebagai gaya debye, dan tidak hanya bergantung pada jarak antara kedua molekul atau antara molekul kutub dan atom individu, tetapi juga tergantung pada kemampuan polarisasi molekul apolar dan besarnya dari momen dipol molekul kutub.
Contoh molekul yang telah menginduksi interaksi dipol-dipol
Interaksi semacam ini hanya diberikan antara molekul yang berbeda, karena satu diperlukan untuk menjadi kutub dan yang lain tidak. Beberapa contoh adalah:
- Atom gas mulia seperti argon dan senyawa kutub seperti hidrogen klorida. Dalam hal ini, beban parsial positif dalam hidrogen HCl menarik elektron valencia argon, menghasilkan dipol kecil yang diinduksi pada yang terakhir. Jika argon mendekati atom klorin, beban parsial negatif akan mengusir elektron valensi dan dipol yang diinduksi juga terbentuk.
- Brominasi molekul (br2) Ini sangat larut dalam air, meskipun merupakan senyawa apolar dan air dari pelarut yang sangat polar. Penjelasannya, sebagian, karena kemampuan polarisasi yang tinggi dari bromin yang memungkinkan Anda untuk membentuk interaksi yang sangat kuat.
3. Diinduksi Dipolo-dipolo yang diinduksi interaksi atau kekuatan dispersi London
Dari semua pasukan van der Waals, yang terlemah adalah pasukan dispersi London. Interaksi ini diberikan antara semua atom dan molekul karena penampilan dipol instan di bagian mana pun dari strukturnya.
Dipol instan adalah dipol kecil yang dibentuk oleh distribusi asimetris elektron valensi pada waktu tertentu.
Dapat melayani Anda: hidrokarbon tak jenuhBagaimana dipol instan dihasilkan?
Karena elektron berputar di sekitar nukleus, dapat terjadi bahwa pada suatu waktu ada lebih banyak elektron di satu sisi daripada dari yang lain, yang memunculkan dipol. Dipol kecil ini menghilang dengan cepat ketika elektron terus bergerak di sekitar nukleus, dan itulah sebabnya mereka disebut snapshot.
Dipol instan dapat muncul di mana saja dalam struktur molekul dan pada waktu tertentu mungkin ada banyak dari mereka. Kekuatan dispersi London terdiri dari interaksi antara masa -masa instan ini dalam satu molekul dan yang lainnya.
Contoh senyawa yang memiliki kekuatan dispersi London
Seperti disebutkan, jenis interaksi ini terjadi antara semua atom dan molekul. Namun, ia berada dalam molekul apolar besar di mana efeknya dapat lebih baik diamati, karena dalam kasus ini adalah satu -satunya jenis interaksi antarmolekul yang terjadi.
Contoh khas di mana gaya -kekuatan ini sangat intens adalah dalam kasus hidrokarbon alifatik rantai panjang, terutama dalam polimer seperti polietilen.

