Galvanoplasty

- 4862
- 817
- Miss Marion Graham
Kami menjelaskan apa yang terdiri dari galvanoplasty, juga disebut elektrodeposisi, bagaimana prosesnya, contoh -contoh praktis dan aplikasinya.
 Galvanoplasti dari sendok
Galvanoplasti dari sendok Apa itu galvanoplasty?
Galvanoplasti atau elektrodeposisi adalah teknik elektrokimia yang terdiri, seperti namanya, dalam menyimpan lapisan logam pada objek penerima; Yaitu, menutupinya dari penutup logam, yang ketebalannya berkisar antara 5-20 μm.
Teknik ini juga dikenal sebagai electrochapado atau berlapis elektrolitik, sebagai media elektrolitik yang terdiri dari ion logam logam yang diinginkan untuk disimpan sangat diperlukan untuk implementasinya. Oleh karena itu, jika kita ingin tembaga berlapis (tembaga), kita akan membutuhkan garam yang larut dalam tembaga, seperti tembaga sulfat, dilarutkan dalam air.
Alasan sebelumnya berlaku untuk logam lain: pelapis elektrolitik emas akan membutuhkan garam emas, biasanya sianida emas, yang bisa menjadi sangat beracun. Dengan demikian, beberapa objek, seperti peralatan makan, dapat dilapisi dengan emas untuk memberikan nilai dan kemuliaan yang lebih besar.
Tapi galvanoplasty melampaui estetika: mereka diberikan. Ini juga memungkinkan menghemat sumber daya alam, karena tidak perlu menghabiskan sejumlah besar logam untuk pelapis.
Proses galvanoplasti
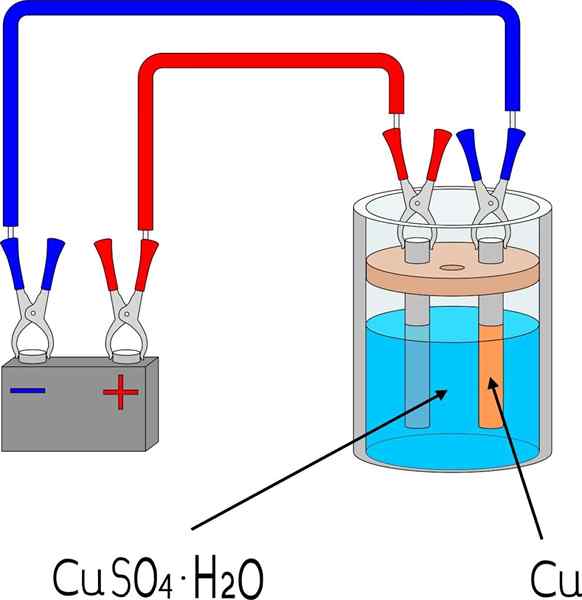 Elektrodeposisi tembaga di kamar mandi tembaga sulfat
Elektrodeposisi tembaga di kamar mandi tembaga sulfat Item
Untuk electrodepose logam pada permukaan, beberapa elemen dasar diperlukan, yang dimensi dan mode akan bervariasi tergantung pada batch objek yang akan ditutupi.
Pada gambar atas, misalnya, elektroda tembaga skala kecil ditampilkan, dapat direproduksi di laboratorium atau ruang mana pun.
Media elektrolitik
Pertama, diperlukan media elektrolit logam untuk elektrodeposit. Garam Tembaga Sulfat, Cuo4, Itu sangat larut dalam air, jadi membawa ion Cu2+ yang kemudian akan direduksi menjadi atom Cu0. Atom -atom ini adalah yang akan dirakit pada permukaan penerima untuk menimbulkan kristal logam.
Media elektrolitik sangat diperlukan agar sirkuit bekerja dan beban ionik dapat bergerak atau memobilisasi ke arah daerah di mana elektrodeposisi terjadi.
Elektroda
Elektroda adalah permukaan tempat elektrodeposisi terjadi dari basis kimianya. Dalam istilah sederhana ada dua elektroda: katoda, yang merupakan tempat logam adalah electrodepos; Dan anoda, yang merupakan tempat reaksi kimia terjadi yang menyumbangkan elektron ke ion logam yang akan menutupi katoda.
Itu dapat melayani Anda: uretan: struktur, sifat, mendapatkan, menggunakanYaitu, katoda menjadi bagian yang diinginkan. Sementara itu, anoda adalah permukaan apa pun di mana suatu spesies mengoksidasi dan menyumbangkan elektronnya ke katoda. Sering kali anoda terbuat dari logam yang sama yang dilarutkan di lingkungan elektrolitik. Jika ada ion tembaga di tengah, dalam hal ini anoda akan menjadi tembaga logam.
Sirkuit eksternal
Sirkuit eksternal adalah baterai yang menyediakan elektron awal yang mempromosikan elektrodeposisi. Kehadirannya berarti bahwa reaksinya tidak spontan: listrik diperlukan untuk menghasilkan perubahan kimia, yang merupakan pengurangan ion logam terlarut.
Pembersihan elektroda
Potongan yang harus ditutup harus benar -benar bersih. Jika tidak, pelapis atau lapisan akan rusak.
Untuk melakukan ini, Anda harus memastikan bahwa permukaannya sepenuhnya hidrofilik, yaitu, ia tidak memiliki lemak atau kotoran apa pun. Salah satu cara untuk memastikan ini, setelah pencucian kimia, adalah dengan membasahi potongan dengan air, dan jika pembentukan air tetesan atau tetesan cairan yang tidak seragam diamati, itu berarti bahwa elektroda belum bersih.
Reaksi dan makna elektron
Galvanoplasty adalah reaksi redoks. Oleh karena itu: satu spesies harus dikurangi, sedangkan yang lain teroksidasi, atau sebaliknya. Di tembaga, kami memiliki anoda yang terbuat dari tembaga, dan katoda yang terbuat dari logam saya (besi, seng, timah, dll.).
Saat kita menyalakan baterai, mereka akan mengalir elektron ke katoda, yang mulai mengisi daya secara negatif.
Beban negatif katoda menarik kation Cu2+ dari lingkungan elektrolitik, terjadi pengurangan:
Cu2+(Ac) +2e- → Cu
Itu bisa melayani Anda: reaksi maillardBaterai perlu memulihkan elektron yang disumbangkan, dan juga ion Cu harus dipulihkan2+ dikurangi untuk mempertahankan netralitas lingkungan elektrolitik. Inilah saat anoda datang dalam fungsi: atom tembaga teroksidasi:
Cu (S) → Cu2+(Ac) +2e-
Dan elektron yang dilepaskan diarahkan kembali ke baterai, yang pada gilirannya memobilisasi mereka ke katoda untuk melanjutkan elektrodeposisi.
Anoda mendapatkan beban positif, yang menarik ion SO42- dari media elektrolitik (lihat gambar sekali lagi).
Artinya, reaksi yang terjadi adalah reduksi dan oksidasi tembaga, logam yang electrodepos:
Cu2+(Ac) +2e- → Cu
Cu (S) → Cu2+(Ac) +2e-
Anoda, tembaga, kehilangan adonan sementara katoda, logam lain, ditutupi dengan lapisan tembaga halus.
Contoh galvanoplasty
Perak
Logam bisa "elektroplasi", yang secara elektrolitik menutupi mereka dari lapisan perak. Ini sangat bermanfaat dalam komponen elektronik yang harus menghantarkan listrik. Perak bisa menjadi electrodeposita pada baja, tembaga, nikel dan logam lainnya.
Yg dikalengi
Tinner adalah elektrodeposisi timah. Ini sangat berguna dalam produksi kaleng besi, yang ditutupi dengan timah untuk membuatnya tahan terhadap korosi, dan dengan demikian tidak merusak makanan atau produk yang disimpan.
Latin atau Tan
Meskipun sedikit lebih rumit, kuningan dan perunggu juga bisa menjadi elektrodepos pada beberapa logam untuk meningkatkan penampilan mereka.
Zincado
Seng atau seng galvanoplasti (tidak membingungkan dengan termal galvanis) sebagian besar digunakan untuk memberikan resistensi zat besi terhadap korosi dan permukaan yang lebih cerah dan lebih menarik. Dengan demikian, fungsinya adalah estetika dan pada saat yang sama fungsional, dan ditemukan di bagian tubuh seperti roda.
Plastik logam
Plastik, yang sebelumnya diperlakukan memiliki permukaan konduktif, juga dapat ditutupi dengan logam, yang seolah -olah mereka dipatuhi selembar foil aluminium.
Dapat melayani Anda: Kitaso FlaskAplikasi Galvanoplasty
Aplikasi galvanoplasty atau elektrodeposisi dapat dibagi menjadi fungsional atau estetika.
Fungsional
 Elektrodepos emas tipis di pemirsa kasus astronot memungkinkan mereka untuk melindungi mata mereka dari sinar matahari
Elektrodepos emas tipis di pemirsa kasus astronot memungkinkan mereka untuk melindungi mata mereka dari sinar matahari Melapisi bagian atau objek adalah memberikan permukaannya dengan sifat -sifat yang tidak dimiliki sendiri. Sebagai contoh, tembaga atau elektrodposisi elektrodik membuat potongan yang mereka miliki, sehingga sangat ideal di sirkuit elektronik untuk mengambil keuntungan dari sifat -sifat logam ini, tanpa perlu menghabiskan banyak emas untuk pembuatan potongan utuh dan padat dan padat yang kuat dan padat.
Emas, di sisi lain, melindungi permukaan panas dan radiasi. Karena alasan inilah banyak yang digunakan dalam satelit dan di helm astronot, karena mencerminkan sinar matahari sehingga meningkatkan mata mereka, atau dengan cepat panas.
Baja krom atau julukan sangat tahan terhadap korosi berkat tepatnya untuk lapisan logam ini. Itulah sebabnya galvanoplasty digunakan dalam industri ini untuk melindungi logam yang peka terhadap corrod.
Estetika
Veneer logam bersinar. Seng, nikel dan kromium banyak digunakan untuk tujuan ini. Juga, emas dan perak adalah electrodepos dalam cincin, rantai, gelang, choker, lereng, dll., Dan oleh karena itu galvanoplastinya menemukan banyak aplikasi di toko perhiasan dan ornamen, untuk meningkatkan citra dan prestise pakaian ini.
Referensi
- Shiver & Atkins. (2008). Kimia anorganik. (Edisi keempat). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Wikipedia. (2021). Elektroplating. Diperoleh dari: di.Wikipedia.org
- Chris Woodford. (28 Juli 2020). Bagaimana elektroplating bekerja. Diperoleh dari: explinthatstuff.com
- Rob Snyder. (S.F.). Elektrodeposisi skala nano. Institut Pendidikan STEM. [PDF]. Pulih dari: skala nano.UNL.Edu
- Elsevier b.V. (2021). Elektrodeposisi. Ilmiah. Diperoleh dari: Scientedirect.com
- Vaishali Mittal. (10 Desember 2020). Elektroplating. Libretteks Kimia. Pulih dari: chem.Librettexts.org
- Singh Davneet. (9 Juni 2020). Berbagai jenis elektropling. Pulih dari: Teachoo.com
- Helmestine, Anne Marie, PH.D. (26 Agustus 2020). Apa itu elektroplating dan bagaimana cara kerjanya? Pulih dari: thinkco.com

