Model Gas Ideal, Perilaku, Contoh
- 4168
- 61
- Miss Marion Graham
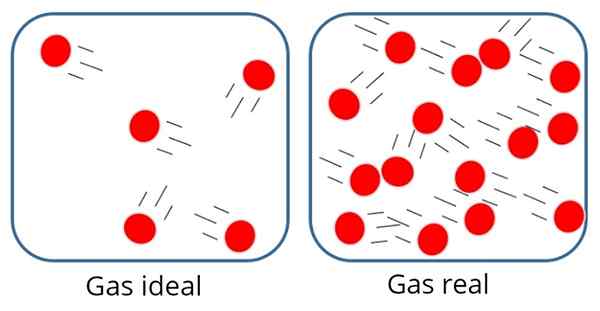
A Gas Ideal salah satu Gas sempurna Ini adalah salah satu di mana gaya tarik atau tolakan molekuler dianggap tidak signifikan antara partikel yang menyusunnya, oleh karena itu, semua energi internalnya adalah kinetik, yaitu energi yang terkait dengan gerakan tersebut.
Dalam gas seperti itu, partikel biasanya cukup jauh dari satu sama lain, meskipun kadang -kadang bertabrakan satu sama lain dan dengan dinding wadah.
 Dalam gas ideal partikel -partikel itu jauh dari satu sama lain
Dalam gas ideal partikel -partikel itu jauh dari satu sama lain Di sisi lain, dalam gas ideal ukuran atau massa partikel tidak penting, karena volume yang ditempati oleh mereka seharusnya sangat kecil dibandingkan dengan volume gas itu sendiri.
Ini, tentu saja, hanya pendekatan, karena pada kenyataannya selalu ada beberapa tingkat interaksi antara atom dan molekul. Kita juga tahu bahwa partikel -partikel itu menempati ruang dan memiliki massa.
Namun, asumsi ini bekerja cukup baik dalam banyak kasus, seperti gas dengan berat molekul rendah, dalam kisaran tekanan dan suhu yang baik.
Namun, gas dengan berat molekul tinggi, terutama pada tekanan tinggi atau suhu rendah, tidak berperilaku sama sekali sebagai gas ideal dan membutuhkan model lain yang dibuat dengan tujuan menggambarkannya dengan presisi yang lebih besar.
[TOC]
Eksperimen Pertama
Undang -undang yang mengatur gas adalah empiris, yaitu, mereka muncul dari eksperimen. Eksperimen yang paling menonjol dilakukan selama abad ketujuh belas, kedelapan belas dan awal abad kesembilan belas.
Pertama adalah Robert Boyle (1627-1691) dan Edme Mariotte (1620-1684), yang secara mandiri memodifikasi tekanan dalam gas dan mendaftarkan perubahan mereka volume, menemukan bahwa mereka berbanding terbalik: pada tekanan yang lebih besar, lebih sedikit volume.
 Robert Boyle
Robert Boyle Untuk bagiannya, Jacques Charles (1746-1823) menetapkan volume itu dan suhu absolut secara langsung proporsional, selama tekanan tetap konstan.
Ini dapat melayani Anda: Gelombang Stasioner: Rumus, Karakteristik, Jenis, ContohAmadeo Avogadro (1776-1856) menemukan bahwa dua volume identik dari gas yang berbeda mengandung jumlah partikel yang sama, selama tekanan dan suhu adalah sama. Dan akhirnya Joseph de Gay Lussac (1778-1850), mengatakan bahwa dengan menjaga volume tetap, tekanan dalam gas berbanding lurus dengan suhu.
Hukum gas ideal
Penemuan ini diungkapkan melalui formula sederhana, panggilan P untuk tekanan, V untuk volume, N ke jumlah partikel dan T Suhu gas yang ideal:
Hukum Boyle-Maleotte
Asalkan suhu sudah diperbaiki, hal berikut terjadi:
P⋅V = konstan
Hukum Charles
Saat gas berada di bawah tekanan konstan:
V / t = konstan
Hukum Gay Lussac
Menjaga gas pada volume tetap adalah benar bahwa:
p / t = konstan
Hukum Avogadro
Volume gas yang identik, di bawah tekanan dan kondisi suhu yang sama memiliki jumlah partikel yang sama. Oleh karena itu kita bisa menulis:
V ∝ n
Di mana n adalah jumlah partikel dan ∝ adalah simbol proporsionalitas.
Model Gas Ideal
Model Gas Ideal menggambarkan gas sedemikian rupa sehingga:
-Ketika partikel berinteraksi melakukannya untuk waktu yang sangat singkat, melalui bentrokan elastis, di mana dorongan dan energi kinetik dipertahankan.
-Partikel -partikel konstituennya tepat waktu, dengan kata lain, diameternya jauh lebih rendah dari jarak rata -rata yang mereka tempuh antara satu dan tabrakan lainnya.
-Kekuatan antar molekul tidak ada.
-Energi kinetik sebanding dengan suhu.
Gas monoatomik - yang atomnya tidak saling terkait - dan berat molekul rendah, dalam kondisi standar tekanan dan suhu (tekanan atmosfer dan suhu 0 º C), mereka memiliki perilaku sedemikian rupa sehingga model gas ideal adalah deskripsi yang sangat baik untuk mereka.
Ini dapat melayani Anda: Vy Canis Majoris: Penemuan, Karakteristik, Struktur, Pelatihan dan EvolusiPersamaan Status Gas Ideal
Hukum gas di atas digabungkan untuk membentuk persamaan umum yang mengatur perilaku gas ideal:
V ∝ n
V ∝ t
Karena itu:
V ∝ N⋅t
Selain itu, hukum Boyle:
V = konstan / p
Maka kita bisa menegaskan itu:
V = (konstan x n⋅t) / p
Konstanta disebut konstanta gas Dan itu dilambangkan dengan huruf r. Dengan pilihan ini, persamaan gas yang ideal menghubungkan empat variabel yang menggambarkan keadaan gas, yaitu N, R, P dan T, meninggalkan:
P⋅V = n⋅r⋅t
Persamaan yang relatif sederhana ini konsisten dengan hukum gas ideal. Misalnya, jika suhunya konstan, persamaannya dikurangi menjadi hukum Boyle-Maleotte.
Konstanta gas
Seperti yang telah kami katakan sebelumnya, dalam kondisi suhu dan tekanan standar, yaitu, pada 0ºC (273.15 k) dan 1 atmosfer tekanan, perilaku banyak gas dekat dengan gas ideal. Dalam kondisi ini, volume 1 mol gas adalah 22.414 l.
Dalam hal itu:
R = (p⋅v) / (n⋅t) = (1 atm x 22.414 l) / (1 mol x 273.15 k) = 0.0821 atm ⋅ l /mol ⋅ k
Konstanta gas juga dapat diekspresikan dalam unit lain, misalnya dalam sistem internasional jika layak:
R = 8.314 j⋅ mol-1⋅ k-1
Ketika masalah diselesaikan melalui undang -undang gas ideal, lebih mudah untuk memperhatikan unit -unit di mana konstanta diungkapkan, karena seperti yang dapat kita lihat, ada banyak kemungkinan.
Perilaku Gas Ideal
Seperti yang telah kami katakan, gas apa pun dalam kondisi tekanan dan suhu standar yang berat molekul rendah, berperilaku sangat dekat dengan gas ideal. Oleh karena itu, persamaan P⋅V = N⋅r⋅t berlaku untuk menemukan hubungan antara empat variabel yang menggambarkannya: n, p, v dan t.
Itu bisa melayani Anda: model atom HeisenbergDengan cara ini kita dapat membayangkan bagian gas yang ideal terkunci dalam wadah dan dibentuk oleh partikel -partikel kecil, yang sesekali bertabrakan satu sama lain dan dengan dinding wadah, selalu elastis.
Inilah yang kita lihat dalam animasi porsi helium berikut, gas yang mulia dan monoatomik:
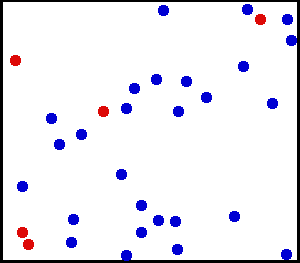 Helium adalah gas mulia, dalam animasi sebagian atom helium ditampilkan dalam wadah. Yang merah berfungsi untuk membedakan gerakan dengan lebih baik. Sumber: Wikimedia Commons.
Helium adalah gas mulia, dalam animasi sebagian atom helium ditampilkan dalam wadah. Yang merah berfungsi untuk membedakan gerakan dengan lebih baik. Sumber: Wikimedia Commons. Contoh Gas Ideal
Gas yang ideal adalah gas hipotetis, yaitu, ini adalah idealisasi, namun, dalam praktiknya banyak gas yang berperilaku sangat dekat, sehingga memungkinkan untuk model P⋅V = n⋅r⋅t yang tepat.
gas mulia
Contoh gas yang berperilaku sebagai cita -cita dalam kondisi standar adalah gas mulia, serta gas cahaya: hidrogen, oksigen dan nitrogen.
Balon aerostatik
 Model Gas Ideal menjelaskan bagaimana balon udara panas. Sumber: Wikimedia Commons.
Model Gas Ideal menjelaskan bagaimana balon udara panas. Sumber: Wikimedia Commons. Ke balon aerostatik Gambar 1 dapat diterapkan oleh hukum Charles: gas dipanaskan, oleh karena itu udara yang mengisi dunia mengembang dan sebagai akibatnya naik.
Balon Helium
Helium, bersama dengan hidrogen, elemen paling umum di alam semesta, namun langka di bumi. Karena gas mulia lembam, tidak seperti hidrogen, jadi balon penuh helium banyak digunakan sebagai elemen dekoratif.
Referensi
- Atkins, hlm. 1999. Kimia Fisik. Edisi Omega.
- Chang, R. 2013. Kimia. 11va. Edisi. Pendidikan MC Graw Hill.
- Cengel, dan. 2012. Termodinamika. Edisi ke -7. Bukit McGraw.
- Cimbala, c. 2006. Mekanika Cairan, Fundamental dan Aplikasi. MC. Bukit Graw.
- Giambattista, a. 2010. Fisika. 2nd. Ed. Bukit McGraw.
- « Karakteristik lingkungan alami, elemen, pentingnya, contoh
- Contoh dan karakteristik fungsi banding »

