Sifat gas, perilaku, bentuk, contoh

- 2143
- 379
- Ernesto Mueller
Itu Gas Mereka semua adalah zat atau senyawa yang merupakan keadaan agregasinya lemah dan tersebar, sementara sangat tergantung pada kondisi tekanan dan suhu yang mengaturnya. Mungkin merupakan bentuk kedua materi yang lebih berlimpah di seluruh alam semesta setelah plasma.
Di bumi gas membentuk lapisan atmosfer, dari eksosfer, ke troposfer dan udara kita bernafas. Meskipun gas tidak terlihat ketika disebarluaskan oleh ruang besar, seperti langit, ia terdeteksi oleh pergerakan awan, belokan bilah pabrik, atau oleh uap yang dihembuskan dari mulut kita di iklim dingin.
 Gas dapat diamati pada cerobong industri atau rumah, serta di menara asap yang berasal dari gunung berapi. Sumber: Pxhere.
Gas dapat diamati pada cerobong industri atau rumah, serta di menara asap yang berasal dari gunung berapi. Sumber: Pxhere. Demikian juga, pergi ke aspek negatif lingkungan, diamati dalam asap hitam pipa knalpot kendaraan, di kolom asap menara yang terletak di pabrik, atau di asap yang terangkat ketika hutan terbakar.
Itu juga menghadapi fenomena gas ketika uap terlihat yang meninggalkan selokan, dalam api nasib rawa dan kuburan, dalam oksigen bubb yang dilepaskan oleh produk tanaman fotosintesis mereka, dan bahkan di erut dan perut kembung.
Di mana pun gas diamati, itu berarti ada reaksi kimia, kecuali jika mereka diperbaiki atau berasimilasi langsung dari udara, sumber utama gas (dangkal) dari planet ini. Ketika suhu meningkat, setiap zat (elemen kimia) akan diubah menjadi gas, termasuk logam seperti besi, emas dan perak.
Terlepas dari sifat kimia gas, setiap orang berbagi kesamaan jarak yang memisahkan partikel mereka (atom, molekul, ion, dll.), yang bergerak kacau dan sewenang -wenang dengan volume atau ruang tertentu.
[TOC]
Sifat gas
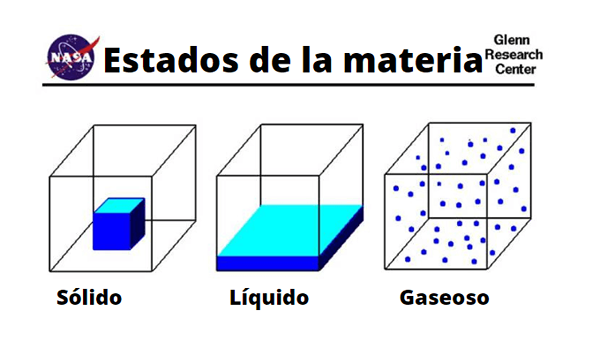 Perbedaan molekul padat, cair dan gas
Perbedaan molekul padat, cair dan gas Fisik
Sifat fisik gas bervariasi tergantung pada zat atau senyawa apa itu. Populer gas dikaitkan dengan bau atau busuk yang buruk, karena kandungan belerangnya, atau dengan adanya amina yang mudah menguap. Demikian juga, mereka divisualisasikan dengan warna hijau, coklat atau kekuningan, yang mengintimidasi dan memberikan pertanda buruk.
Namun, sebagian besar gas, atau setidaknya yang paling berlimpah, sebenarnya tidak berwarna dan tidak berbau. Bahkan jika mereka tidak terikat, mereka dapat dirasakan di kulit dan menentang resistensi gerakan, bahkan menciptakan lapisan kental dalam tubuh yang melintasi mereka (seperti halnya dengan pesawat).
Semua gas dapat mengalami perubahan tekanan atau suhu yang akhirnya membuat cairan masing -masing; yaitu, mereka menderita kondensasi (jika didinginkan) atau pencairan (jika mereka "ditekan").
 Kondensasi; keadaan gas ke keadaan cair
Kondensasi; keadaan gas ke keadaan cair Di sisi lain, gas mampu melarutkan dalam cairan dan beberapa padatan berpori (seperti karbon aktif). Gelembung adalah hasil dari kelompok gas yang belum larut di tengah dan keluar ke permukaan cair.
Konduktivitas listrik dan termal
Dalam kondisi normal (tanpa ionisasi partikelnya), gas adalah pendorong buruk panas dan listrik. Namun, ketika mereka tegang dengan banyak elektron, mereka memungkinkan perjalanan arus melalui mereka, seperti yang terlihat dalam sinar selama badai.
Di sisi lain, dengan tekanan rendah dan mengalami medan listrik, beberapa gas, terutama yang mulia atau sempurna, menerangi dan lampu mereka digunakan untuk desain kehidupan malam dan poster (cahaya neon), serta dalam kejutan listrik yang terkenal yang terkenal lampu di lentera jalanan.
Dapat melayani Anda: keseimbangan granataria: karakteristik, bagian dan cara menggunakannyaMengenai konduktivitas termal, banyak gas berperilaku sebagai isolator termal, sehingga penggabungannya ke dalam pengisian serat, jaringan, atau panel kaca, membantu mencegah panas dari menyeduhnya dan menjaga suhu tetap konstan.
Namun, ada gas yang merupakan konduktor panas yang baik, dan dapat menyebabkan luka bakar lebih buruk yang disebabkan oleh cairan atau padatan; Misalnya, seperti uap panas dari kue yang dipanggang (atau empanada), atau dengan jet uap yang luput dari boiler.
Reaktivitas
Umumnya reaksi yang melibatkan gas, atau di mana terjadi, digambarkan sebagai berbahaya dan rumit.
Reaktivitasnya tergantung, sekali lagi, pada sifat kimianya; Namun, ketika memperluas dan memobilisasi sangat, lebih banyak perawatan dan kontrol harus diambil karena mereka dapat memicu peningkatan tekanan drastis yang menempatkan struktur reaktor dalam risiko; Belum lagi seberapa mudah terbakar atau tidak bahagia gas.
Perilaku gas
Secara makroskopis seseorang dapat memberikan gambaran tentang perilaku gas dengan menyaksikan bagaimana asap, cincin, atau "bahasa" sastra dari rokok berevolusi di udara. Juga, ketika granat asap meledak, menarik untuk merinci pergerakan awan -awan ini dengan warna yang berbeda.

Namun, pengamatan semacam itu tunduk pada aksi udara, dan juga fakta bahwa ada partikel padat yang sangat halus yang tersuspensi dalam asap. Oleh karena itu, contoh -contoh ini tidak cukup untuk mencapai kesimpulan tentang perilaku gas yang sebenarnya. Sebaliknya, eksperimen telah dilakukan dan mengembangkan teori kinetik gas.
Partikel molekuler dan idealnya, gas yang secara elastis bertabrakan satu sama lain, memiliki perpindahan linier, rotasi dan getaran. Mereka memiliki energi terkait rata -rata, yang memungkinkannya melakukan perjalanan dengan bebas melalui ruang apa pun tanpa hampir berinteraksi atau bertabrakan dengan partikel lain saat volume meningkat di sekitarnya.
Perilakunya akan menjadi campuran dari gerakan Brown yang tidak menentu, dan tabrakan bola biliar yang terpental tanpa henti satu sama lain dan dinding meja; Jika tidak ada dinding, mereka akan menyebar ke arah tak terbatas, kecuali mereka mempertahankannya: gravitasi.
Bentuk gas
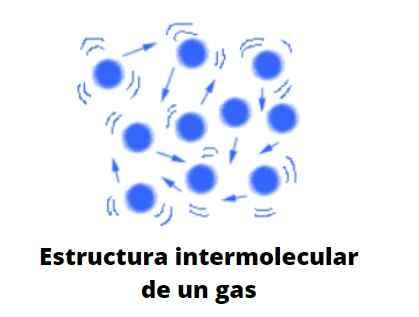
Gas, tidak seperti cairan dan padatan, tidak tunduk pada tipe kental; yaitu, agregasi atau kohesi partikel mereka tidak pernah berhasil mendefinisikan bentuk. Mereka berbagi dengan cairan fakta bahwa mereka sepenuhnya menempati volume wadah yang mengandungnya; Namun, mereka tidak memiliki ketegangan permukaan dan permukaan.
Jika konsentrasi gas tinggi, "bahasa" Anda atau bentuk makroskopis yang sudah dijelaskan dapat divisualisasikan dengan mata telanjang. Ini, cepat atau lambat, akan berakhir memudar karena aksi angin atau hanya dengan perluasan gas. Oleh karena itu gas menutupi semua sudut ruang terbatas yang menyebabkan sistem yang sangat homogen.
Sekarang, teori ini dengan mudah menganggap gas sebagai bidang yang nyaris tidak bertabrakan dengan diri mereka sendiri; Tetapi ketika mereka melakukannya, mereka bangkit secara elastis.
Bola -bola ini sangat terpisah satu sama lain, sehingga gas -gas praktis "penuh" vakum; Dari sana Anda berutang fleksibilitas untuk melewati celah atau fisura sekecil apa pun, dan kemudahan untuk dapat mengompresnya secara signifikan.
Dapat melayani Anda: oksida non -metalikItulah sebabnya, betapapun menutup pemasangan toko roti, jika berjalan di samping, pasti bahwa aroma roti yang baru dipanggang akan dinikmati.
Tekanan gas
Dapat diyakini bahwa dengan begitu tersebar dan memisahkan bola atau partikel gas, ini tidak dapat menghasilkan tekanan pada tubuh atau benda. Namun, atmosfer menunjukkan bahwa keyakinan seperti itu salah: ia memiliki massa, menimbang dan mencegah cairan dari penguapan atau mendidih dari ketiadaan. Titik mendidih diukur pada tekanan atmosfer.
Tekanan Gase menjadi lebih dapat diukur jika manometer tersedia, atau jika terkunci dari wadah dinding yang tidak dapat dibentuk. Dengan demikian, semakin banyak partikel gas di dalam wadah, semakin besar jumlah tabrakan di antara mereka dan dinding yang sama.
Partikel -partikel ini saat bertabrakan dengan dinding menekannya, karena mereka menggunakan kekuatan mereka dengan kekuatan yang sebanding dengan energi kinetiknya. Seolah -olah bola biliar yang ideal ke dinding kewalahan; Jika ada banyak yang berdampak pada mereka dengan kecepatan tinggi, itu bisa pecah.
Unit
Ada banyak unit yang menyertai pengukuran tekanan gas. Beberapa yang paling terkenal adalah milimeter merkuri (mmHg), serta torr. Adalah yang dari sistem unit internasional (SI) yang mendefinisikan Pascal (PA) dalam hal n/m2; Dan dia, kilo (KPa), mega (MPa) dan giga (GPa) Pascal.
Volume gas
Gas menempati dan mengembang di seluruh volume wadah. Semakin besar wadah, volume gas juga akan; Tetapi tekanan dan kepadatan mereka akan berkurang untuk jumlah partikel yang sama.
Gas itu sendiri, di sisi lain, memang memiliki volume terkait yang tidak terlalu bergantung pada sifat atau struktur molekulnya (idealnya), tetapi pada kondisi tekanan dan suhu yang mengaturnya; Ini, volume molarnya.
Pada kenyataannya, volume molar bervariasi dari satu gas ke gas lainnya, meskipun variasinya kecil jika mereka bukan molekul heterogen dan besar. Misalnya, volume molar amonia (NH3, 22.079 l/mol) pada 0 ºC dan 1 atm, berbeda dari helium (dia, 22.435 l/mol).
Semua gas memiliki volume molar yang berubah tergantung pada p dan t, dan terlepas dari seberapa besar partikel mereka, jumlahnya selalu sama. Dari sini ia memperoleh apa yang dikenal dengan nomor Avogadro (nKE).
Hukum Gas Utama
Perilaku Gase telah belajar sejak berabad -abad terakhir melalui eksperimen, pengamatan mendalam dan interpretasi hasil.
Eksperimen semacam itu memungkinkan serangkaian undang -undang yang, berkumpul dalam persamaan yang sama (yaitu gas ideal), membantu memprediksi respons gas terhadap kondisi tekanan dan suhu yang berbeda. Dengan cara ini, ada hubungan antara volume, suhu dan tekanannya, serta jumlah tahi lalat mereka dalam sistem tertentu.
Di antara undang-undang ini adalah empat berikut: Boyle, Charles, Gay-Lussac dan Avogadro.
Hukum Boyle
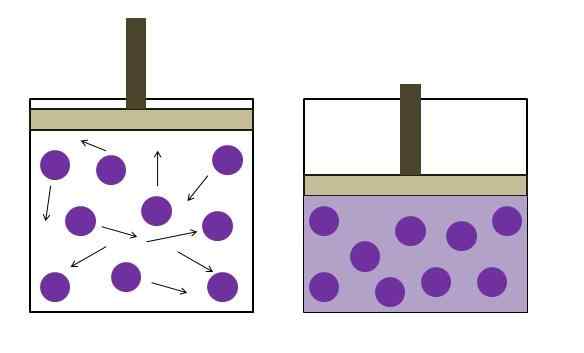 Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar
Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar Hukum Boyle menetapkan bahwa pada suhu yang konstan, volume gas ideal berbanding terbalik dengan tekanannya; Inilah, semakin besar wadahnya, semakin rendah tekanan yang akan dialami dindingnya dengan jumlah gas yang sama akan dialami.
Itu dapat melayani Anda: Charles Law: Formula dan Unit, Eksperimen, LatihanHukum Charles
 Lentera atau keinginan Cina. Sumber: Pxhere.
Lentera atau keinginan Cina. Sumber: Pxhere. Hukum Charles menetapkan bahwa pada tekanan konstan, volume gas ideal berbanding lurus dengan suhunya. Balon mendemonstrasikan Charles '.
Hukum Gay-Lussac
Hukum Gay-Lussac menetapkan bahwa pada volume konstan, tekanan gas ideal berbanding lurus dengan suhunya. Dalam kuali tertutup dengan baik jika gas semakin memanas, setiap kali tekanan di dalamnya akan lebih besar, karena dinding kuali tidak cacat atau melebar; Yaitu volumenya tidak berubah, itu konstan.
Hukum Avogadro
Akhirnya, hukum Avogadro menetapkan bahwa volume yang ditempati oleh gas ideal berbanding lurus dengan jumlah partikelnya. Dengan demikian, jika Anda memiliki mol partikel (6.02 · 1023), maka volume gas molar akan.
Jenis gas
Gas yang mudah terbakar
Ini adalah gas yang komponennya berfungsi sebagai bahan bakar, karena mereka digunakan untuk produksi energi termal. Beberapa dari mereka adalah gas alam, minyak cair dan gas hidrogen.
Gas Industri
Ini adalah gas yang diproduksi, yang dipasarkan kepada publik untuk berbagai penggunaan dan aplikasi, seperti untuk sektor kesehatan, makanan, perlindungan lingkungan, metalurgi, industri kimia, keamanan, antara lain. Beberapa gas ini adalah oksigen, nitrogen, helium, klorin, hidrogen, karbon monoksida, propana, metana, nitro oksida, antara lain.
Gas inert
Mereka adalah gas -gas yang dalam kondisi suhu dan tekanan tertentu, tidak menghasilkan reaksi kimia atau sangat rendah. Mereka adalah neon, argon, helium, kripton dan xenon. Mereka digunakan dalam proses kimia di mana elemen non -reaktif diperlukan.
Contoh elemen dan senyawa gas
Apa elemen gas dari tabel periodik dalam kondisi terestrial?
Kami pertama kali memiliki hidrogen (H), yang membentuk molekul H2. Itu diikuti oleh helium (dia), gas mulia yang lebih ringan; dan kemudian nitrogen (n), oksigen (O) dan fluoride (f). Tiga terakhir ini juga membentuk molekul diatomik: n2, SALAH SATU2 dan f2.
Setelah fluoride muncul neon (NE), gas mulia yang mengikuti helium. Di bawah fluor kami memiliki klorin (CL), dalam bentuk molekul CL2.
Kemudian kita memiliki sisa gas mulia: argon (ar), kripton (kr), xenón (xe), radon (rn) dan oganeson (OG).
Oleh karena itu, mereka adalah total dua belas elemen gas; sebelas jika kita mengecualikan Oganeson yang sangat radioaktif dan tidak stabil.
Senyawa gas
Selain elemen gas, beberapa senyawa gas umum akan terdaftar:
-H2S, hidrogen sulfida, bertanggung jawab atas bau telur busuk
-NH3, amonia, aroma penetrasi yang dirasakan pada sabun bekas
-BERSAMA2, Karbon dioksida, gas rumah kaca
-TIDAK2, nitrogen dioksida
-Tidak, nitrogen monoksida, gas yang diyakini sangat beracun tetapi memainkan peran penting dalam sistem peredaran darah
-Sw3, Sulfur trioksida
-C4H10, butana
-HCl, hidrogen klorida
-SALAH SATU3, ozon
-Sf6, Hexafluoruro dari sulfur
Referensi
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (Edisi ke -8.). Pembelajaran Cengage.
- Sifat gas. Diperoleh dari: chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Gas. Diperoleh dari: di.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (5 Desember 2018). Gas - Sifat Umum Gas. Pulih dari: thinkco.com
- Watch Kesehatan Pria Harvard. (2019). Keadaan gas. Pulih dari: kesehatan.Harvard.Edu
- Editor pendingin elektronik. (1 September 1998). Konduktivitas termal gas. Pulih dari: pendingin elektronik.com

